某碳酸钠样品中含有少量氯化钠杂质,为测定该样品中碳酸钠的质量分数,进行了如下实验:
① 实验一:

请回答下列问题:
(Ⅰ)操作A中用到玻璃棒,其作用是 。
(Ⅱ)甲同学取少量(碳酸钠样品)溶液,滴入无色酚酞试液,溶液由无色变成 。
(Ⅲ)在实验过程中加入饱和石灰水后发生反应的化学方程式是 。
(Ⅳ)为探究上述反应后滤液中的溶质成分,乙同学向滤液中滴加过量稀盐酸,发现
有气泡产生,则滴加盐酸前滤液中的溶质除氯化钠外还有 。
② 实验二:
丙同学取12g该碳酸钠样品放入烧杯中,加入100g稀盐酸(足量),完全反应后, 所
得溶液质量为107.6 g。试计算:
(Ⅰ)生成二氧化碳物质的量为 mol。
(Ⅱ)碳酸钠样品中Na2CO3的质量分数。(写出计算过程,保留到0.1%)
(Ⅲ)如果测得的结果比实际的质量分数高,可能的原因是 。(答一种即可)
①实验一
(Ⅰ)引流 (Ⅱ)红色 (Ⅲ)Na2CO3 +Ca(OH)2 = 2NaOH +CaCO3↓
(Ⅳ)碳酸钠、氢氧化钠(写化学式也可)(错、漏一个不得分)
②实验二:(Ⅰ)0.1mol
(Ⅱ)88.3%
(Ⅲ)稀盐酸挥发出的HCl气体随CO2气体排出,从而导致所测样品中碳酸钠的质量分数偏大。(或水蒸气随CO2气体排出,从而导致所测样品中碳酸钠的质量分数偏大)(1分)
题目分析:碳酸钠样品中含有少量氯化钠杂质,加水溶解后得到碳酸钠溶液,含少量氯化钠,溶液呈碱性,加酚酞应变红色,碳酸钠能和氢氧化钙反应,化学方程式为Na2CO3 +Ca(OH)2 = 2NaOH +CaCO3↓,有沉淀生成,所以A操作为过滤,玻璃棒作用为引流;滴加过量稀盐酸,发现有气泡产生,则一定有碳酸钠,另外氢氧化钠也一定有,因为上述反应不仅生成沉淀,也生成了氢氧化钠,所以滤液中还有氢氧化钠和碳酸钠;总质量减少,减少的质量即为生成二氧化碳的质量,为112-107.6=4.4g,物质的量为0.1mol,
然后根据化学方程式计算:设样品中含碳酸钠Xmol
Na2CO3+2HCl=2NaCl+H2O+CO2↑
1mol 1mol
x 0.1g
1∶1= x∶0.1 x = 0.1mol
样品中碳酸钠的质量分数为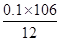 ×100% = 88.3%
×100% = 88.3%
如果测得的结果比实际的质量分数高,则二氧化碳的量应该偏大,由此可推出原因可能为稀盐酸挥发出的HCl气体随CO2气体排出或水蒸气随CO2气体排出,导致测定的二氧化碳量偏大,所以求出来碳酸钠的质量分数偏大。
