用如图所示的方法研究钠与水反应的性质,其中A是用带孔的铝箔包裹着的小钠块。
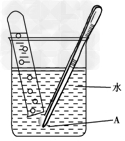
(1)从大块钠上取下的小块钠要用滤纸擦一擦,这样做的目的是 ________________________________________________________________________。
(2)包裹钠块的铝箔要预先刺上适当大、足够多的小 孔,若孔过小或数目不够,可能出现的不良后果是________;假如在实验刚开始后就将镊子松开拿出水面,A表现出来的现象是________;出现这种现象的原因是 _____________________________________。
(3)据预测,钠与水反应生成氢气和氢氧化钠。
①证明生成的气体是氢气的实验方法是 ___________________________________________________________。
②证明生成氢氧化钠的实验方法和相应的现象是 ___________________________________________________________。
③钠跟水反应的化学方程式是: _____________________________。
(4)如果用盐酸代替水做钠的性质研究的实验有一定的危险,主要原因是 ________________________________________。
(5)如果用饱和碳酸钠溶液代替水做钠的性质研究的实验。
①有金属钠参加的化学反应的方程式是: ____________________________。
②其他化学反应的方程式是(假设溶液的温度保持不变) _______________________。
③再向烧杯中加入足量的稀盐酸,反应的化学方程式是: _______________________。
(1)擦去钠表面的煤油,避免影响实验效果
(2)发生爆炸;浮上水面;钠的密度小于水的密度,反应生成的氢气增大了A所受的浮力
(3)①在气体充满或基本充满试管时,在水中单手握管身、拇指封管口,管口朝下移出水面。在火焰的近处横置试管,管口靠近火焰,松开拇指点燃气体,听到轻微的“噗”声;
②向烧杯内的溶液中滴入3滴酚酞试液,溶液显红色;
③2Na+2H2O===2NaOH+H2↑
(4)钠与盐酸反应非常剧烈,生成H2的同时放出大量热,易发生爆炸
(5)①2Na+2H2O===2NaOH+H2↑;②Na2CO3+10H2O===Na2CO3·10H2O;③NaOH+HCl===NaCl+H2O,2HCl+Na2CO3===CO2↑+H2O+2NaCl
