水和二氧化碳而变质。某实验小组为确定一瓶久置的碱石灰样品的成分,设计了如图所示实验流程。
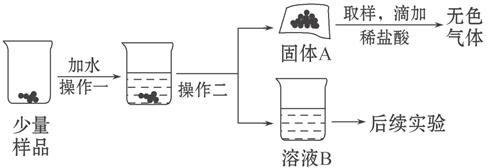
请你参与探究过程:
(1)为了使样品充分溶解,操作一还要用到的玻璃仪器是 ;操作二的名称是 。
(2)固体A中一定含有 。
(3)溶液B成分的探究:
【查阅资料】①Ca(OH)2、Na2CO3溶于水无明显的温度变化;
②Na2CO3溶液呈碱性,能使酚酞试液变红;
③CaCl2溶液呈中性。
【猜想】溶液B中的溶质可能为:①NaOH ②Na2CO3
③NaOH和Na2CO3④Ca(OH)2和 (填化学式)。
【设计方案并进行实验】甲、乙同学分别设计如下方案并进行探究:
甲同学:取少量溶液B于试管中,滴加足量的稀盐酸,产生大量气泡,则溶液B中的溶质是Na2CO3。
乙同学:取少量溶液B于试管中,滴加几滴酚酞试液,溶液变成红色,则溶液B中的溶质一定含有NaOH。
【反思与评价】丙同学认真分析上述两位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断。他认为溶液B中的溶质一定含有Na2CO3,可能含有NaOH。为进一步确认溶液B中是否含NaOH,他做了如下实验。
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量溶液B于试管中,加入足量CaCl2溶液 ②过滤,在滤液中滴加酚酞试液 | ①有白色沉淀生成 ②溶液由无色变为红色 | 猜想③正确 |
实验步骤①中发生的化学反应方程式是 ,其实验目的是 。
(4)实验过程中,同学们发现向样品中加水时还放出大量的热,综合以上探究,下列对样品成分分析正确的是 (填序号)。
A.一定有NaOH
B.一定有Na2CO3
C.一定有CaO
D.至少有NaOH、CaO中的一种
(1)玻璃棒 过滤 (2)碳酸钙(或CaCO3) (3)【猜想】NaOH 【反思与评价】CaCl2+Na2CO3=2NaCl+CaCO3↓ 除尽溶液B中的Na2CO3,避免干扰NaOH的检验(或除去溶液B中的Na2CO3) (4)B、D
本题以探究样品成分为主题,考查学生对酸、碱、盐的性质、科学探究的认识及综合分析能力。
(1)加水后,为使样品溶解,可用玻璃棒搅拌,通过操作②得到固体和溶液,故该操作为过滤;(2)样品吸收二氧化碳后,可能发生的反应有CaO+H2O=Ca(OH)2,CO2+Ca(OH)2=CaCO3↓+H2O,CO2+2NaOH=Na2CO3+H2O,Na2CO3+Ca(OH)2= CaCO3↓+2NaOH。故过滤得到的固体中一定有CaCO3,还可能有未溶解的Ca(OH)2,因为Ca(OH)2微溶于水。(3)【猜想】溶液中还可能含有未变质或因反应生成的NaOH;【反思与评价】步骤①加入足量的CaCl2,是为了除去溶液中的Na2CO3,避免Na2CO3造成碱性的干扰;(4)放热的原因可能是CaO溶于水,也可能是NaOH溶于水造成的,还有可能是二者共同溶于水造成的,不可确定,但一定含有Na2CO3,故应选B、D。
