问题
填空题
为了除去氯化钠样品中的碳酸钠杂质,兴趣小组最初设计了如下的方案并进行实验。
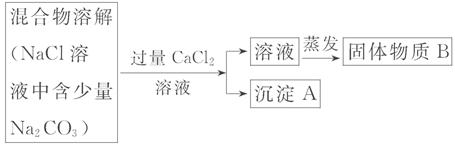
(1)写出沉淀A的化学式 。
(2)加入CaCl2溶液后,分离除去沉淀A的实验操作和蒸发所共同用到的一种玻璃仪器是 。
(3)同学在实验过程中,又发现了新的问题:此方案很容易引入新的杂质,请写出固体物质B的成分 (用化学式表示)。
(4)同学继续探究后又提出新的方案:将混合物溶解,若滴加过量盐酸至不再产生气体为止,则既能除去Na2CO3杂质,又能有效地防止新杂质的引入。写出有关反应的化学方程式: 。
(5)你认为物质B中是否含有杂质氯化氢 (填“是”或“否”),理由是 。
答案
(1)CaCO3 (2)玻璃棒 (3)NaCl、CaCl2
(4)Na2CO3+2HCl=2NaCl+H2O+CO2↑
(5)否 氯化氢受热时易挥发
溶液中的碳酸钠可与加入的CaCl2反应,发生的反应是Na2CO3+CaCl2=CaCO3↓+2NaCl,这样虽除去了杂质Na2CO3,但过量的CaCl2成为新的杂质,分离除去沉淀A的实验操作是过滤,过滤和蒸发都用到玻璃棒;引入的新杂质为未反应完的CaCl2。
