(9分)海水是巨大的资源宝库。如图所示利用海水为原料可获得许多化工产品:
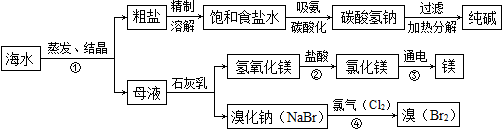
(1)步骤①中选用蒸发结晶法而不用降温结晶法的理由是 。
(2)制纯碱过程中,其中过滤操作所需要的玻璃仪器有烧杯、漏斗和 。
(3)步骤②发生反应的化学方程式是 ,其基本反应类型为 。用镁制造的一种镁铝合金常用作生产飞机外壳的材料,该材料具有的优良性能有 (任答一点)。
(4)步骤④发生的反应为置换反应(类似于金属与盐溶液之间的反应),试写出该反应的化学方程式 ;此反应能够发生是因为 。
(1)氯化钠的溶解度受温度影响较小 (2)玻璃棒
(3)Mg(OH)2+2HCl ="=" MgCl2+2H2O 复分解反应 质量轻或强度大或抗腐蚀
(4)2NaBr + Cl2="=" 2NaCl + Br2 氯元素的非金属性强于溴元素或氯(或氯气)的活泼性强于溴或氯原子得电子的能力强于溴或氯的氧化性强于溴
题目分析::(1)因为氯化钠的溶解度受温度的影响很小,所以用蒸发结晶法;(2)过滤用于分离固体和液体的混合物,过滤操作所需要的玻璃仪器有烧杯、漏斗和玻璃棒;(3)步骤②是氢氧化镁和盐酸的反应,反应的化学方程式为Mg(OH)2+2HCl=MgCl2+2H2O,反应类型是复分解反应,镁和铝制成的合金具有强度高而密度小,机械性能好,韧性和抗蚀性能好等优良性能;(4)步骤④发生的反应的化学方程式是2NaBr+Cl2═2NaCl+Br2;反应原因是氯气的非金属性比溴的非金属性强。
