合成氨工业的核心反应是:N2(g)+3H2(g)  2NH3(g) ΔH=Q kJ·mol-1,能量变化如下图,回答下列问题:
2NH3(g) ΔH=Q kJ·mol-1,能量变化如下图,回答下列问题:
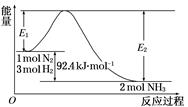
(1)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”、“减小”或“不变”)。
(2)在500℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量________ 46.2 kJ(填“<”、“>”或“=”)。
(3)关于该反应的下列说法中,正确的是________。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS>0 D.ΔH<0,ΔS<0
(4)将一定量的N2(g)和H2(g)放入1 L密闭容器中,在500℃、2×107Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。计算该条件下达到平衡时H2转化为NH3的转化率________。若升高温度,K值变化________(填“增大”、“减小”或“不变”)。
(5)在上述(4)反应条件的密闭容器中,欲提高合成氨中H2的转化率,下列措施可行的是________(填字母)。
A.向容器中按原比例再充入原料气
B.向容器中再充入惰性气体
C.改变反应的催化剂
D.分离出氨气
(1)减小 减小 (2)< (3)D (4)33.3% 减小 (5)A、D
(1)在反应体系中加入催化剂,降低了反应的活化能,即E1减小,E2减小,反应热不变。
(2)由图像可知N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1,使用催化剂,加快了反应速率,但平衡并不移动,平衡转化率不变,上述反应仍不能进行彻底,故0.5 mol N2和1.5 mol H2充分反应后放出的热量应小于46.2 kJ。
(3)由图可知ΔH<0,根据反应方程式可知气体的物质的量减小,ΔS<0。
(4) N2(g)+3H2(g)2NH3(g)
起始: m n 0
转化: x 3x 2x
平衡: m-x n-3x 2x
根据题意m-x=0.1 mol n-3x=0.3 mol 2x=0.1 mol
故x=0.05 mol m=0.15 mol n=0.45 mol
α(H2)= =
=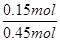 ×100%=33.3%。
×100%=33.3%。
ΔH<0,升温,平衡左移,K值减小。
(5)欲提高H2的转化率应使平衡右移,向容器中按原比例再充入原料气,相当于增大压强,平衡右移,A可行,B中充惰性气体对平衡无影响,C中改变催化剂不改变平衡移动,D中分离出氨气,平衡右移,方法可行,故选A、D。
