(6分)某化学兴趣小组查阅资料得知,粗盐除NaCl外,还含有MgCl2、CaCl2以及泥沙等杂质。为了将粗盐提纯,设计了以下操作流程:
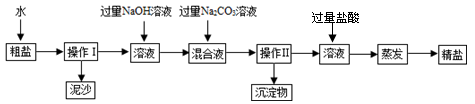
请你根据以上信息回答下述问题:
(1)操作Ⅰ的名称为_______________。
(2)加入过量氢氧化钠溶液,发生化学反应的方程式为 。
(3)加入过量碳酸钠溶液的实验目的是 。
经过操作Ⅱ所得溶液中含有的阴离子是 。
过滤
(4)某同学所得精盐比其他同学明显要多,原因可能是__________。AB
_______ ____
A.滤纸破损,滤液浑浊就蒸发
B.蒸发时未用玻璃棒,有一些液体溅出
C.提纯后所得精盐尚未完全干燥
D.溶解时水的量太少,使食盐未完全溶解
(1)过滤 (1分);(2)2NaOH + MgCl2 = 2NaCl + Mg(OH)2↓(2分);
(3) 除去溶液中的钙离子(或填“氯化钙”)(1分)Cl- 、OH- 、CO32-(1分);(4)A、C(2分).
题目分析:(1)操作Ⅰ得到泥沙和溶液,故为过滤;(2)氢氧化钠能与氯化镁反应生成氢氧化镁沉淀和氯化钠;(3)碳酸钠能与氯化钙生成碳酸钙沉淀,过量能全部除去氯化钙杂质;因为加入的试剂过量,故经过操作Ⅱ所得溶液中含有的阴离子有Cl- 、OH- 、CO32-;(4)某同学所得精盐比其他同学明显要多,即固体增多:A.精盐中很有含有泥沙,B.液体溅出,会使固体减少;C.金阿姨中含有水分,使质量增大;D.会使精盐质量减少.
