(5分)某实验小组利用废硫酸液制备K2SO4的流程如下:
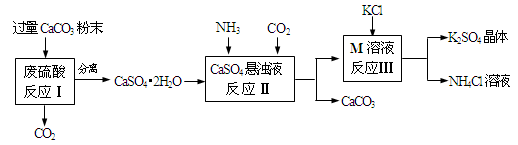
⑴ 将CaCO3研成粉末的目的是 。
⑵ 上述流程中可循环使用的物质有CO2和 (填写化学式)。
⑶ 反应Ⅲ中相关物质的溶解度如下表所示。你认为反应Ⅲ在常温下能实现的原因是
。
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(1)加快反应速率,使反应更充分(提高原料利用率等)
(2)CaCO3 (3)常温下K2SO4的溶解度小 (4)c a
题目分析:(1)反应速率的快慢与反应物的接触面积有关,故将CaCO3研成粉末的目的是:加快反应速率,使反应更充分(提高原料利用率等)
(2)循环使用即既作为反应物,又是反应的生成物,所以上述流程中可循环使用的物质有CO2和CaCO3
(3)根据复分解反应发生的条件,M溶液是(NH4)2SO4溶液,加入KCl,相互交换成分得到K2SO4和NH4Cl,所以结合表中的溶解度数值,判断反应Ⅲ在常温下能实现的原因是:常温下K2SO4的溶解度小
(4)根据(3)分析,反应得到K2SO4和NH4Cl,为检验此晶体是否洗涤干净,实际上就是检验洗涤液中是否含有NH4Cl,所以可取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,除去K2SO4,再向上层清液中滴加AgNO3溶液,看是否产生沉淀,故分别选c 、a-的检验





