常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到200mL C(OH-)=0.1mol/L的溶液,然后逐滴加入1mol/L 的盐酸,测得生成沉淀的质量m与消耗盐酸的体积V关系如图所示,则下列说法正确的是( )
A.原合金质量为 0.92 g
B.图中V2为 60
C.整个加入盐酸过程中 Na+的浓度保持不变
D.Q点m1为1.56
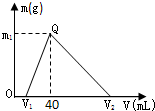
由图象可知,向合金溶解后的溶液中加盐酸,先发生NaOH+HCl═NaCl+H2O,后发生NaAlO2+HCl+H2O═NaCl+Al(OH)3↓,最后发生Al(OH)3↓+3HCl═AlCl3+3H2O,
合金溶解后剩余的氢氧化钠的物质的量为0.2L×0.1mol/L=0.02mol,由NaOH+HCl═NaCl+H2O,则V1为
=0.02L=20mL,生成沉淀时消耗的盐酸为40mL-20mL=20mL,其物质的量为0.02L×1mol/L=0.02mol,由 NaAlO2+HCl+H2O═NaCl+Al(OH)3↓,0.02mol 1mol/L
0.02mol 0.02mol 0.02mol
A、由钠元素及铝元素守恒可知,合金的质量为0.04mol×23g/mol+0.02mol×27g/mol=1.46g,故A错误;
B、由Al(OH)3↓+3HCl═AlCl3+3H2O可知,溶解沉淀需要0.06molHCl,其体积为60mL,则V2为40mL+60mL=100mL,故B错误;
C、由2Na+2H2O═2NaOH+H2↑、2Al+2H2O+2NaOH═2NaAlO2+3H2↑,加盐酸后,先发生NaOH+HCl═NaCl+H2O,后发生NaAlO2+HCl+H2O═NaCl+Al(OH)3↓,最后发生Al(OH)3↓+3HCl═AlCl3+3H2O,随着盐酸的量的加入,体积增大,钠离子的量不变,所以浓度减小,故C错误;
D、由上述计算可知,生成沉淀为0.02mol,其质量为0.02mol×78g/mol=1.56g,故D正确;
故选D.
