目前,计算机已进入千家万户.制造计算机的芯片需要大量的高纯硅,生产高纯硅的主要原料是沙子(主要成分为SiO2).二氧化硅既不溶于水,也不溶于一般的酸溶液.
工业上生产高纯硅的主要过程示意图如下: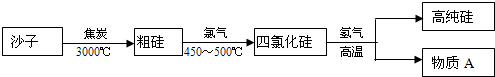
其主要反应原理为:
①SiO2+2C
Si(粗)+2CO②Si(粗)+2Cl23000℃ .
SiCl4400~500℃ .
③SiCl4+2H2
Si(纯)+4HCl高温 .
请你根据上述材料,回答下列问题:
(1)由沙子制得高纯硅的反应原理中,属于化合反应的是______填数字代号,下同),属于置换反应的是______.
(2)由粗硅提纯得到高纯硅必须在无氧的氛围中进行,除了考虑到硅易被氧化成二氧化硅外,还有一个原因是______.
(3)生产过程示意图中的“物质A”用水吸收,可得副产品(一种常见的酸)的名称是______.
(4)作为电器、电子、光纤等行业用高纯硅原料的沙子,纯度要求高,需要对普通沙子(含有少量的CaCO3、Fe2O3)进行提纯,其中用酸洗(用盐酸)和高纯水洗是两个最重要的步骤.请写出酸洗步骤中的两个反应的化学方程式分别是______、______;判断用高纯水洗是否洗净的方法是:取少量最后的洗涤液于试管中,向其中滴加AgNO3溶液和稀硝酸,若无______现象,则表明残留物已洗净;否则,表明残留物未洗净.
(1)反应②为两种物质生成一种物质的化合反应;反应①③为单质与化合物生成单质与化合物的置换反应;故答案为:②;①③;
(2)反应中使用氢气,氢气若与氧气混合易引起爆炸,因此必须在无氧的氛围中进行;故答案为:防止O2进去与H2混合引起爆炸;
(3)根据反应的化学方程式可判断物质A为HCl,溶于水可得到盐酸溶液;故答案为:盐酸;
(4)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,氧化铁与盐酸反应生成氯化铁和水;向水洗后的溶液中滴加硝酸银,如果出现白色沉淀说明溶液中含有氯离子,表明残留物未洗净,如果不出现沉淀说明溶液中不含氯离子,表明残留物洗净;故答案为:CaCO3+2HCl═CaCl2+CO2↑+H2O(或Fe2O3+6HCl═2FeCl3+3H2O);白色沉淀
故答案为:(1)②;①③;(2)防止O2进去与H2混合引起爆炸;(3)盐酸;(4)CaCO3+2HCl═CaCl2+CO2↑+H2O(或Fe2O3+6HCl═2FeCl3+3H2O);白色沉淀.