People travel for a lot of reasons. Some tourists go to see battlefields or other historic remains. Others are looking for culture, or simply want to have their pictures taken in front of famous places. Most European tourists are looking for a sunny beach to lie on.
Northern Europeans are willing to pay a lot of money for the sun because they have so little of it. People in cities like London, Copenhagen and Amsterdam spend much of their winter in the dark because the days are so short, and much of the year it rains. This is the reason why the Mediterranean (地中海) has always attracted them. Every summer many people travel to Mediterranean resorts (度假胜地) and beaches for their vacation. They all come for the same reason. Sun!
The huge crowds mean lots of money for the economies of Mediterranean countries. Italy's 30,000 hotels are booked without a break every summer. And 13 million people visited French beaches, parks, and roadsides. Spain's long sandy coastline attracts more people than anywhere else. 37 million tourists visit there yearly, or one tourist for each person living in Spain.
But there are signs that the area is getting more tourism than it can deal with. The Mediterranean is already one of the most polluted seas on earth. None of this, however, is ruining anyone's fun. Obviously, visitors don't go there for clean water. They allow traffic jams and endure crowded beaches. They don't even mind the pollution. No matter how dirty the water is , the coastline still looks beautiful. And as long as the sun shines, it's still better than sitting in cold Berlin, London, or anywhere else.
64. The writer seems to infer that Europeans travel mostly for the reason that _____.
A. they want to see historic remains
B. they wish to escape from cold, dark and rainy days
C. they would like to take pictures in front of famous places
D. they are interested in different cultural and social customs
65. According to the passage, which of the following countries attracts more tourists than the others?
A. Italy. B. Greece. C. France. D. Spain.
66. The underlined part in Passage 3, "one tourist for each person living in Spain" means _____.
A. all the 37 million people living in Spain are tourists
B. every person living in Spain has to take care of a tourist
C. every year as many tourists visit Spain as there are people living in that country
D. every family in Spain is visited by a tourist every year
67. According to the passage, which of the following might ruin the tourists' fun at Mediterranean resorts and beaches?
A. Polluted water B. Crowded buses C. Rainy weather D. Traffic jams

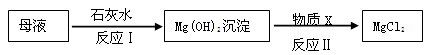
 (5)从下列装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为
(5)从下列装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为 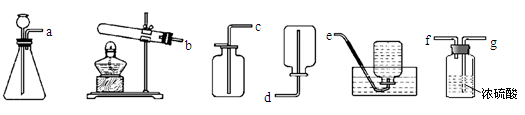
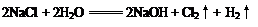 (2分)
(2分) 
