(12分)二十一世纪是海洋开发与利用的世纪,我市实施黄蓝两大国家战略形成新的发展格局,海洋化学资源的综合利用将是重点发展领域之一。
(1)海水晒盐:将海水引入蒸发池,经日晒蒸发到一定程度时,导入结晶池,继续日晒,海水就会成为食盐的饱和溶液,再晒就会逐渐析出粗盐,剩余的液体称为母液(也称卤水)。
1L海水在逐渐浓缩过程中不断析出的盐的种类和质量(单位:g)关系如下表所示:
| 海水密度(g/mL) | CaSO4 | NaCl | MgCl2 | MgSO4 |
| 1.20 | 0.91 | |||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 |
| 1.31 | 1.40 | 0.54 | 0.03 |
II、若得到纯度较高的粗盐和含浓度较高的卤水,卤水的密度应控制在什么范围 ,原因是 。
(2)海水制镁:海水晒盐后,以其母液(卤水)和贝壳(主要成分是CaCO3)为原料制镁,其工艺流程如下图所示:
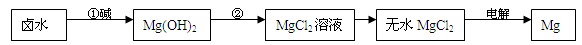
I、步骤①所加的碱应该是 (选填“氢氧化钠”或“石灰乳”),步骤②反应的化学方程式是 ;若要验证镁、铁、铜的活动性顺序,选择铁丝后,还要选择 、 两种溶液。
II、Mg(OH)2加热分解生成MgO和H2O,MgO是高熔点的化合物,某些阻燃剂(阻碍燃烧的物质)的有效成分是Mg(OH)2。你认为Mg(OH)2能够阻燃的原因可能是 (选填序号)
A.Mg(OH)2分解需要吸收大量的热,降低了可燃物的着火点
B.生成的氧化镁覆盖在可燃物表面,隔绝了空气
C.生成的水蒸气降低了可燃物周围氧气浓度
D.反应因吸热降低了环境温度,使可燃物不易达到着火点
(1)I、物理;结晶;II、1.21g•mL-1~1.26g•mL-1范围内;尽可能使氯化钠析出,尽少减少杂质盐类的析出;(2)I、石灰乳;Mg(OH)2+2 HCl=MgCl2+H2O;氯化镁、硫酸铜;II、BCD。
题目分析:I、海水晒盐是将水蒸发而使溶解的食盐析出,过程中没有生成新物质,为物理变化,包含蒸发和结晶等过程。
II、根据表格可知:当卤水的密度在1.21g•mL-1~1.26g•mL-1范围内时;溶解的氯化钠较少,溶解的盐类杂质较多。可以达到:尽可能使氯化钠析出,尽少减少杂质盐类的析出的目的。
(2)I、石灰乳的成分为氢氧化钙,价格较低,更易获得,所以步骤①所加的碱应该是石灰乳。步骤②时氢氧化镁转化为氯化镁,反应的化学方程式为Mg(OH)2+2 HCl=MgCl2+H2O;
可能过铁与镁盐的溶液验证铁与镁的活动性强弱;可能过铁与铜盐溶液是否反应验证铁与铜的活动性强弱。所以还要选择氯化镁、硫酸铜两种溶液。(也可选其它的可溶解性镁盐与铜盐的溶液)
II、A、Mg(OH)2分解需要吸收大量的热,降低了可燃物的温度而不是着火点。此项不正确。B、生成的氧化镁是高熔点的化合物,覆盖在可燃物表面,可使可燃物与空气隔绝。此项正确。C、生成的水蒸气降低了可燃物周围氧气浓度,使燃烧的剧烈程度降低。此项正确。D、反应因吸热降低了环境温度,使可燃物不易达到着火点。此项正确。所以应选BCD项。
