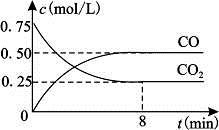
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
(1)下列措施中能使平衡时K增大的是___________(填序号);
A.升高温度 B.增大压强C.充入一定量COD.降低温度
(2)8分钟内,CO的平均反应速率v(CO)=___________mol/(L·min);
(3)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
| 容器 | 甲 | 乙 |
| 反应物投入量 | 3molFe、2molCO2 | 4molFeO、3molCO |
| CO的浓度(mol/L) | C1 | C2 |
| CO2的体积分数 | 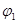 | 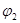 |
| 体系压强(Pa) | P1 | P2 |
| 气态反应物的转化率 | 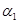 | 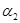 |
A.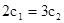 B.
B.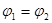 C.P1<P2D.
C.P1<P2D.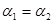
②求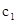 =___________、
=___________、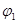 =___________、
=___________、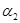 =___________。
=___________。
(共13分)(1)A 2分 (2)0.0625 2分
(3)①BC 2分 ②C1=0.67mol/L 3分  2分
2分  2分
2分
题目分析:(1)正方应是吸热反应,平衡时升高温度平衡向正反应方向移动,平衡常数K值增大,A正确;B、反应前后体积不变,则增大压强平衡不移动,而平衡常数只与温度有关系,则K值不变,B不正确;C、充入一定量CO,平衡向逆反应方向移动,但平衡常数不变,C不正确;D、降低温度平衡向逆反应方向移动,平衡常数减小,D不正确,答案选A。
(2)8分钟内,生成CO的浓度是0.5mol/L,则CO的平均反应速率v(CO)=0.5mol/L÷8min=0.0625mol/(L·min)。
(3)根据图像可知,该温度下反应的平衡常数K= =
= =2。根据方程式可知,反应前后体积不变,因此3molCO就相当于是3molCO2,所以甲乙两容器中的平衡是等效的,即CO2的体积分数相同,B正确;甲容器中
=2。根据方程式可知,反应前后体积不变,因此3molCO就相当于是3molCO2,所以甲乙两容器中的平衡是等效的,即CO2的体积分数相同,B正确;甲容器中
Fe(s)+CO2(g) FeO(s)+CO(g)
FeO(s)+CO(g)
起始浓度(mol/L) 1 0
转化浓度(mol/L) x x
平衡浓度(mol/L) 1-x x
所以根据平衡常数可知x:(1-x)=2,解得x= ,则C1=
,则C1= ,
, =
=
乙容器中
Fe(s)+CO2(g) FeO(s)+CO(g)
FeO(s)+CO(g)
起始浓度(mol/L) 0 1.5
转化浓度(mol/L) y y
平衡浓度(mol/L) y 1.5-y
所以根据平衡常数可知 ( 1.5-y):y=2,解得y=0.5,则C2=1, =
= ,A不正确,D不正确;
,A不正确,D不正确;
反应前后体积不变,甲中气体的物质的量是3mol,乙中是4mol,则P1<P2,C正确,答案选BC。
②根据以上分析可知C1=0.67mol/L , =
= ,
, =
= 。
。
