Ⅰ、如图所示实验中,如果镁条只与空气中的氧气反应,化学方程式为______,则进入集气瓶中水的体积最多不超过其容积的______.本实验中实际进入集气瓶中水的体积约为其容积的
,则集气瓶中减少的气体中除O2外,一定还有______.3 5
Ⅱ、下列A、B实验中数据变化关系与对应图象相符的是______(填字母序号).

Ⅲ、小雨阅读课外资料得知:氯酸钾分解除了用二氧化锰外,还可用氧化铜等物质作催化剂,于是他对氧化铜产生了探究兴趣.【提出问题】氧化铜是否比二氧化锰催化效果更好?影响氯酸钾分解速率的因素有哪些呢?
【设计实验】小雨以生成等体积的氧气为标准,设计了下列几组实验(其它可能影响实验的因素均忽略).
| 序号 | KClO3的质量 | 其他物质的质量 | 温度 | 氧气的体积 | 反应所需时间 |
| ① | 2.0g | 330℃ | 100mL | t1 | |
| ② | 2.0g | CuO0.5g | 330℃ | 100mL | t2 |
| ③ | 2.0g | MnO20.5g | 330℃ | 100mL | t3 |
| ④ | 2.0g | MnO2______g | 380℃ | 100mL | t4 |
(2)你认为小雨设计实验③和实验②对比的目的是______.
(3)实验④中控制MnO2的质量为______g,若t3>t4,则化学反应快慢与温度的关系是______.
(4)写出实验④所涉及的化学方程式______.
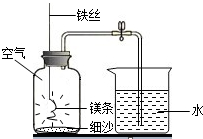
Ⅰ、镁与氧气反应生成氧化镁,反应的化学方程式为2Mg+O2
2MgO;可本实验中实际进入集气瓶中水的体积约为其容积的五分之三,假设氧气全部反应,除氧气外,被消耗的气体体积占集气瓶容积的五分之二,所以被消耗气体占空气的体积超过五分之二,只有氮气符合要求;点燃 .
故答案为:2Mg+O2
2MgO;五分之一;N2;点燃 .
Ⅱ、由于过氧化氢分解产生氧气,所以试管中物质的总质量不断变小,直至反应结束;而加热高锰酸钾时锰元素质量不变,图象应该是一条直线.
故选B.
(1)如果氧化铜能加快氯酸钾的分解速率,实验①比实验②所用时间多.
故答案为:大于;
(2)从图中数据看,KClO3的质量、温度、氧气的体积均相同,因此实验③和实验②对比的目的是探究氧化铜是否比二氧化锰的催化效果更好;
故答案为:探究氧化铜是否比二氧化锰的催化效果更好;
(3)从图中数据看,实验④中控制MnO2的质量为0.5g,若t3>t4,则化学反应快慢与温度的关系是温度越高,反应速率越快;故答案为:0.5g;温度越高,反应速率越快;
(4)氯酸钾在二氧化锰做催化剂、380℃时分解生成氯化钾和氧气,反应的化学方程式是2KClO3
2KCl+3O2↑.MnO2 . 380℃
故答案为:2KClO3
2KCl+3O2↑.MnO2 . 380℃
