同学们在实验室用5%的过氧化氢溶液制取氧气并进行氧气部分性质实验,具体操作如下:
(1)溶液配制:用50mL 30%的过氧化氢溶液配制5%的过氧化氢溶液.溶液配制过程中,除用到玻璃棒外,还需用到下列仪器中的
A、托盘天平 B、烧杯 C、漏斗 D、量筒 E、胶头滴管
(2)气体制备:用配制好的5%的过氧化氢溶液和二氧化锰制取氧气.请你在如图1A、B两套装置中选择其中一套,并说明选择的理由: (合理即可).
(3)性质实验:小明用收集好的氧气,进行了铁丝燃烧的实验.实验前,它在集气瓶底部 ,然后把光亮的细铁丝盘成螺旋状,在铁丝下端系一根火柴,将火柴点燃,待火柴快燃尽时,缓慢插入集气瓶中,观察到的现象是 .
(4)拓展延伸:小亮同学在上述制取氧气的实验过程中,不小心把硫酸铜溶液滴加到了盛有5%的过氧化氢溶液中,立即产生大量气泡,于是引起了小亮同学的探究兴趣.
【提出问题】是哪种粒子能使过氧化氢分解的速率加快呢?
【查阅资料】硫酸铜溶液中含有三种粒子:H2O、SO42﹣、Cu2+
【猜想与假设】Ⅰ、不可能是H2O,理由是 ;
Ⅱ、可能是SO42﹣;
Ⅲ、可能是Cu2+.
【实验验证】如图2所示:
在实验①中加入稀硫酸后,无明显变化,说明 不能使过氧化氢的分解速率加快;
在实验②中加入 后,观察到有大量气泡产生,进一步证明能使过氧化氢分解速率加快的是 .
【结论】实验证明,硫酸铜在该反应前后的质量和化学性质都没有发生变化,硫酸铜是过氧化氢分解的催化剂.
【反思与交流】Ⅰ、检验实验②中产生气体的方法是 ;
Ⅱ、写出过氧化氢在硫酸铜催化作用下发生反应的化学方程式 .
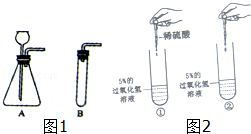
(1)BDE;(2)A,便于添加液体药品制得较多的气体;(3)铺一层水或细沙,剧烈燃烧,火星四射,放出大量热,生成黑色固体;(4)【猜想与假设】Ⅰ、H2O2溶液中有水; 【实验验证】SO42﹣; 硫酸铜;Cu2+;【反思与交流】用带火星的木条,伸入试管,看木条是否复燃; 2H2O2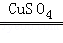 2H2O+O2↑.
2H2O+O2↑.
题目分析::(1)溶液配制:用50ml30%的H2O2溶液(密度为1.13/cm3)配制5%的H2O2溶液(密度约为1g/cm3),步骤为;计算、量取、溶解,因此需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒,故除用到玻璃棒外,还需用到下列仪器中的BDE;(2)气体制备:A装置的长颈漏斗便于添加液体药品制得较多的气体(或B装置简单);(3)为防止生成物炸裂集气瓶,实验前要在集气瓶底部铺一层水或细沙;铁丝在氧气中燃烧现象是:剧烈燃烧,火星四射,放出大量热,生成黑色固体;(4)【猜想与假设】Ⅰ、不可能是H2O,理由是H2O2溶液中有水;在实验①中加入稀硫酸,稀硫酸含有硫酸根离子,无明显变化,说明硫酸根离子不能使过氧化氢的分解速率加快;在实验①已证明硫酸根离子不能使过氧化氢的分解速率加快,在实验②中可以加入硫酸铜来证明Cu2+能使过氧化氢分解速率加快;【反思与交流】Ⅰ、用带火星的木条来检验氧气;Ⅱ、过氧化氢在硫酸铜催化作用下发生反应生成水和氧气;
