党的十八大报告中首次提出“美丽中国”的宏伟目标。节能减排是中国转型发展的必经之路,工业生产中联合生产是实现节能减排的重要措施,下图是几种工业生产的联合生产工艺:
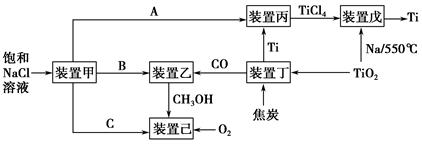
请回答下列问题:
(1)装置甲为电解池,根据图示转化关系可知:A为____________(填化学式),阴极反应式为____________。
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是_________________________________________________
装置戊进行反应时需要的环境为________(填字母序号)。
A.HCl气体氛围中 B.空气氛围中 C.氩气氛围中 D.水中
(3)装置乙中发生的是工业合成甲醇的反应:CO(g)+2H2(g)CH3OH(g) ΔH<0。
①该反应在不同温度下的化学平衡常数(K)如下表:
| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
符合表中的平衡常数x的数值是________(填字母序号)。
A.0 B.0.012 C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
| c(CO) | c(H2) | c(CH3OH) | |
| 0 min | 0.8 mol·L-1 | 1.6 mol·L-1 | 0 |
| 2 min | 0.6 mol·L-1 | y | 0.2 mol·L-1 |
| 4 min | 0.3 mol·L-1 | 0.6 mol·L-1 | 0.5 mol·L-1 |
| 6 min | 0.3 mol·L-1 | 0.6 mol·L-1 | 0.5 mol·L-1 |
反应从2 min到4 min之间,H2的平均反应速率为________。反应达到平衡时CO的转化率为________。反应在第2 min时改变了反应条件,改变的条件可能是________(填字母序号)。
A.使用催化剂 B.降低温度
C.增加H2的浓度
(4)装置己可以看作燃料电池,该燃料电池的负极反应式为____________ ________________________________________________。
(1)Cl2 2H2O+2e-=H2↑+2OH-
(2)进入装置丙的Ti含有的杂质较多,从装置戊中出来的Ti较为纯净 C
(3)①B ②0.3 mol·L-1·min-1 62.5% A
(4)CH3OH+8OH--6e-=CO32—+6H2O
(1)装置甲为电解饱和NaCl溶液的装置,阳极为Cl-失电子,被氧化为Cl2,阴极水电离的H+得电子,生成氢气和NaOH。
(2)装置丙和装置戊的作用是提纯Ti。装置戊中发生的反应是钠还原TiCl4的反应,而高温条件下钠与氧气反应,需要无氧和无水环境。
(3)①ΔH<0,所以正反应为放热反应,故平衡常数随着温度的升高而降低,x<2.041,而且因为是可逆反应,平衡常数不可能为0。②根据表格中CO或CH3OH的浓度可知y=1.2 mol·L-1,所以反应从2 min到4 min之间,H2的平均反应速率为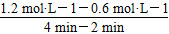 =0.3 mol·L-1·min-1;4 min时,反应达到平衡,故CO的转化率为
=0.3 mol·L-1·min-1;4 min时,反应达到平衡,故CO的转化率为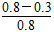 ×100%=62.5%;0~2 min的反应速率比2~4 min的反应速率小,故2 min时可能使用了催化剂。
×100%=62.5%;0~2 min的反应速率比2~4 min的反应速率小,故2 min时可能使用了催化剂。
(4)装置己是由甲醇、氧气、NaOH溶液构成的燃料电池,负极反应为甲醇在碱性条件下失电子的反应。

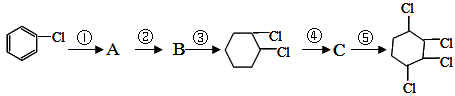
 的所有反应的化学方程式
的所有反应的化学方程式