(15分)海水中富含镁,可经过加碱沉淀、过滤、酸溶、结晶及脱水等步骤得到无水氯化镁,
最后电解得到金属镁。
(1)加碱沉淀镁离子时,生成的Mg(OH)2在分散系中处于沉淀溶解平衡,其溶度积常数表达式
Ksp= 。
(2)MgCl2溶液显酸性,其水解的离子方程式为 。
(3)除去MgCl2酸性溶液中少量的FeCl3,可加入的试剂有
a.MgO b.Mg(OH)2 c.MgCO3 d.MgSO4
(4)若在空气中加热MgCl2·6H2O,可生成Mg(OH)Cl或MgO,写出相关的化学方程式之一
。
(5)MgCl2·6H2O在干燥的HCl气流中加热可得到无水氯化镁,其原因是 。
(6)电解熔融的MgCl2,阳极的电极反应式为: ;阴极的电极反应式为 。
(1)Ksp=c(Mg2+)·c2(OH-) (3分)
(2)Mg2+ + 2H2O  Mg(OH)2 +2H+(2分)
Mg(OH)2 +2H+(2分)
(3)abc(2分)
(4)MgCl2·6H2O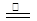 Mg(OH)Cl + HCl↑+5H2O↑或MgCl2·6H2O
Mg(OH)Cl + HCl↑+5H2O↑或MgCl2·6H2O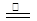 MgO + 2HCl↑+5H2O↑(2分)
MgO + 2HCl↑+5H2O↑(2分)
(5)HCl气流可抑制Mg2+水解(2分)
(6)2Cl――2e-=Cl2↑(2分);Mg2++2e-=Mg(2分)
题目分析:⑴根据Mg(OH)2的溶解平衡式:Mg(OH)2(s) Mg2+(aq)+2OH- (aq),写出其溶度积常数表达式;
Mg2+(aq)+2OH- (aq),写出其溶度积常数表达式;
⑵MgCl2溶液中Mg2+水解:Mg2+ + 2H2O  Mg(OH)2 +2H+,使溶液显酸性;
Mg(OH)2 +2H+,使溶液显酸性;
⑶根据FeCl3的水解:FeCl3+3H2O Fe(OH)3+3HCl,加入MgO、Mg(OH)2、MgCO3均能促进FeCl3的水解,使其转化Fe(OH)3沉淀而除去,同时过量的MgO、Mg(OH)2、MgCO3可通过过滤除去。
Fe(OH)3+3HCl,加入MgO、Mg(OH)2、MgCO3均能促进FeCl3的水解,使其转化Fe(OH)3沉淀而除去,同时过量的MgO、Mg(OH)2、MgCO3可通过过滤除去。
⑷在空气中加热MgCl2·6H2O,促进MgCl2的水解,有HCl、H2O逸出,当生成Mg(OH)Cl时其反应方程式为MgCl2·6H2O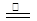 Mg(OH)Cl + HCl↑+5H2O↑;当生成MgO时其反应方程式为MgCl2·6H2O
Mg(OH)Cl + HCl↑+5H2O↑;当生成MgO时其反应方程式为MgCl2·6H2O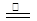 MgO + 2HCl↑+5H2O↑。
MgO + 2HCl↑+5H2O↑。
⑸MgCl2·6H2O在干燥的HCl气流中加热,HCl气流可抑制Mg2+水解,这样可得到无水氯化镁。
⑹电解熔融的MgCl2,阳极发生氧化反应,其电极反应式为2Cl――2e-=Cl2↑;阴极发生还原反应,其电极反应式为Mg2++2e-=Mg。
