溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol/L、c(B )="0.200" mol/L及c(C )="0" mol/L。反应物A的浓度随时间的变化如图所示。
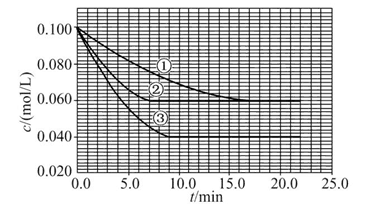
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:② ;③ 。
(2)实验②平衡时B的转化率为 ;实验③平衡时C的浓度为 。
(3)该反应的ΔH 0,其判断理由是 。
(4)该反应进行到4.0 min时的平均反应速率:实验②:v(B)= 。
(1)加催化剂;达到平衡的时间缩短,平衡时A的浓度未变 温度升高;达到平衡的时间缩短,平衡时A的浓度减小
(2)40%(或0.4) 0.06 mol/L
(3)> 升高温度平衡向正反应方向移动,故该反应是吸热反应
(4)0.014 mol/(L·min)
这是一道数形结合的反应原理试题,关键是找出图形中①②③三条曲线的转折点:达到平衡的时间①>③>②,但A的平衡浓度关系是①=②>③,说明②是使用了催化剂,③是升高温度。
(1)②使用了(正)催化剂;理由:因为从图像可看出,两者最终的平衡浓度相同,即最终的平衡状态相同,而②比①所需要的时间短,显然反应速率加快了,故由影响反应速率和影响平衡的因素可知是加入(正)催化剂;③升高温度;理由:因为该反应是在溶液中进行的反应,所以不可能是改变压强引起速率的改变,又由于各物质起始浓度相同,故不可能是改变浓度影响反应速率,再由于③和①相比,③达平衡所需时间短,平衡时浓度更小,故不可能是加催化剂,而只能是升高温度来影响反应速率的。
(2)不妨令溶液为1 L,则②中达平衡时A转化了0.04 mol,由反应计量数可知B转化了0.08 mol,所以B的转化率为 ×100%=40%;同样③中A转化了
×100%=40%;同样③中A转化了
0.06 mol,则生成C为0.06 mol,体积不变,即平衡时c(C)="0.06" mol/L。
(3)ΔH>0;理由:由③和①进行对比可知升高温度后A的平衡浓度减小,即A的转化率升高,平衡向正反应方向移动,而升温是向吸热的方向移动,所以正反应是吸热反应,ΔH>0。
(4)从图上读数,进行到4.0 min时,实验②A的浓度为:0.072 mol/L,则Δc(A)=0.100-0.072=0.028(mol/L),v(A)=Δc(A)/Δt= =
=
0.007 mol/(L·min),所以 v(B)="2v(A)=0.014" mol/(L·min)。
