(5分)某化工厂排出的废水透明、澄清、略显蓝色。某同学取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成。过滤,所得的滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成;另一份滤液中加入氢氧化钠溶液,产生蓝色沉淀。试回答:
(1)废水中一定含有的物质_______(填编号)。
A.氯化物 B.硫酸盐 C.硝酸盐 D.碳酸盐
(2)该同学查阅有关资料后,设计了一个从废水中除去重金属离子的实验方案:
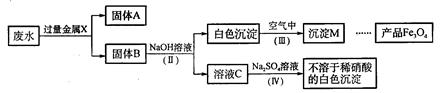
①固体A中一定含有的物质为(写化学式)_______。
②B溶液中的溶质一定含有_______(填序号字母)。
A.Na2CO3 B.Fe(NO3)2 C.MgCl2 D.Ba(NO3)2
③Ⅲ通空气时的化学方程式是4Fe(OH)2+2H2O+O2=4Fe(OH)3,由沉淀M获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O,在第Ⅲ步中应控制“一定量空气”的目的是_______。
④第Ⅳ步反应的化学方程式为_______。
(1) C (2) ①Fe、Cu、Ag ②BD ③ 防止Fe(OH)2全部转化为Fe(OH)3
④Na2SO4+Ba(NO3)2==BaSO4↓+2NaNO3
题目分析:(1)根据实验现象,1、废水透明、澄清、略显蓝色,说明溶液中含有Cu2+,取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成,说明溶液中含有Ag+,则排除Cl-和CO32-,过滤,所得的滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成,说明溶液中含有Ba2+,所以可以确定废水中一定含有的物质是硝酸盐,故选C
(2) ①根据(1)的分析,可以断定废水中一定含有:Ba(NO3)2、Cu(NO3)2、AgNO3,再结合实验方案的流程图,得到的产品中含有铁,所以可判断过量的金属X应是铁,故发生的反应:2AgNO3+Fe==Fe(NO3)2+2Ag,Fe +Cu(NO3)2="=" Fe(NO3)2+Cu,所以固体A中一定含有的物质为:Fe、Cu、Ag;
②所以B溶液中的溶质一定含有生成的Fe(NO3)2,还有未反应的Ba(NO3)2,
③Ⅲ通空气时的化学方程式是4Fe(OH)2+2H2O+O2=4Fe(OH)3,由沉淀M获得Fe3O4的过程中发生的反应为Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O,在第Ⅲ步中应控制“一定量空气”的目的是:防止Fe(OH)2全部转化为Fe(OH)3
④因为B溶液中的溶质含有Fe(NO3)2和Ba(NO3)2,而Fe(NO3)2被NaOH溶液沉淀了,所以溶液C中含有的溶质就是Ba(NO3)2,故第Ⅳ步反应的化学方程式为:Na2SO4+Ba(NO3)2==BaSO4↓+2NaNO3
