问题
填空题
已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示
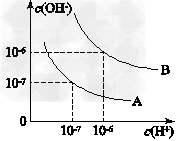
(1)则25 ℃时水的电离平衡曲线应为________(填“A”或“B”),请说明理由_________________________________________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,pH1与pH2之间应满足的关系是________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因___________________________。
答案
(1)A;水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小
(2)10∶1
(3)a+b=14或pH1+pH2=14
(4)曲线B对应95 ℃,此时水的离子积为10-12,HA若为强酸,最后应为pH=6,现pH=5,说明HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+
