问题
推断题
下图表示各物质之间的转化关系。已知D、E、Z是中学化学常见单质,其他都是化合物。Z、Y是氯碱工业的产品。D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题
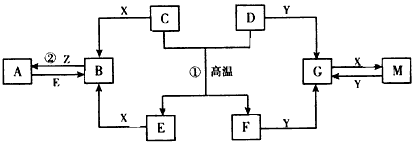
(1)标准状况下,11.2 LH2在Z中完全燃烧生成气态X时,放出Q kJ的热量,请写出相应的热化学反应方程式:_____________________。
(2)G的水溶液显_____(填“酸性”“碱性”或“中性”),其原因是________________ (用离子方程式表示)。
(3)写出反应②的离子方程式:___________________。
(4)写出D与Y的水溶液反应的离子方程式:__________________;若标准状况下有aL气体生成,则该反应转移电子的物质的量为____mol(用含a的代数式表示)。
(5)在电镀工业中,若将E作为待镀金属,锌作为镀层金属,则E是____极,请写出此电极上发生的电极反应式:__________________。
答案
(1)H2(g)+Cl2(g)=2HCl(g) △H=-2Q kJ/mol
(2)碱性;AlO2-+2H2O Al(OH)3+OH-
Al(OH)3+OH-
(3)2Fe2++Cl2=2Fe3++2Cl-
(4)2Al+2OH-+2H2O=2AlO2-+3H2↑
(5)阴;Zn2++2e-=Zn
