实验室常用加热(85℃)NH4Cl和NaNO2两种饱和溶液的方法制取N2,如图是实验室用这种方法制N2,并测定生成N2体积的装置(部分装置略去),请回答相关问题:
【查阅资料】:
1、NH4Cl和NaNO2反应生成NaCl、H2O及N2,并放出大量热量;
2、20℃时,NH4Cl的溶解度约为37g;
3、N2难溶于水,实验条件下,密度为1.25g•L-1.
【实验步骤】:
①______;
②20℃时,取0.78g饱和NH4Cl溶液放入烧瓶,连接装置;
③调节水准管,使其与量气管中液面相平,记录量气管中水面读数为12mL;
④打开分液漏斗活塞,逐滴滴入饱和NaNO2溶液,加热至反应发生,移走酒精灯;
⑤烧瓶中不再产生气泡时,关闭活塞;
⑥待冷却至室温,调节两边液面高度相平,记录量气管中水面读数为VmL;
⑦处理剩余药品,整理实验台.
【实验分析及数据处理】:
(1)写出装置中仪器的名称:a、______;b、______;
(2)反应的化学方程式为:______;
(3)完善实验步骤中的所缺部分:①______;
(4)步骤④中,移走酒精灯的目的是______;
(5)NH4Cl是一种______(填“易溶”、“可溶”、“微溶”、“难溶”)物质.20℃时,其饱和溶液中溶质质量分数为______.根据实验数据计算,生成氮气约为多少毫升?(计算过程中,中间数据保留2位小数,最终结果为整数;相对分子质量:Mr-NH4Cl:53.5、Mr-N2:28)
(6)根据计算结果,步骤⑥中V的数值为______;
(7)实验中,实际测得氮气的体积偏大,可能原因是______.
A.实验中加入饱和NaNO2溶液的体积也被作为生成N2的体积
B.装置漏气.
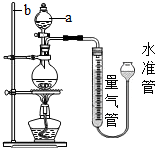
(1)熟记常见仪器的名称,a是分液漏斗,b是铁架台;
(2)反应物是亚硝酸钠和氯化铵,生成物是氯化钠、水、氮气,用观察法配平,所以方程式是:NaNO2+NH4Cl═NaCl+2H2O+N2↑;
(3)该反应为制取氮气的反应,所以需装置不漏气,实验前需检查装置的气密性,方法是关闭分液漏斗下端活塞并将导管连接长导管后置于水中,用酒精灯微热圆底烧瓶,若导管口有气泡冒出,撤掉酒精灯后导管内有一段水柱,则装置气密性好;反之,则装置气密性不好;
(4)NaNO2+NH4Cl
NaCl+N2↑+2H2O↑+Q,+Q说明该反应为放热反应,所以加热片刻后,即应移去酒精灯以防反应物冲出;△ .
(5)20℃时,NH4Cl的溶解度约为37g大于10g属于易溶物质;20℃时,其饱和溶液中溶质质量分数为:
×100%=27%;0.78g饱和NH4Cl溶液中,NH4Cl的质量为:0.78×27%≈0.21g,设反应生成N2的质量为x37g 100g+37g
NaNO2+NH4Cl
NaCl+2H2O+N2↑△ .
53.5 28
0.21g x
根据:
=53.5 28
解得x=0.11g;生成氮气的体积为:0.21g x
=0.088L=88毫升;0.11g 1.25g•L-1
(6)由计算结果可知V=12mL+88mL=100mL;
(7)实验中加入饱和NaNO2溶液的体积也被作为生成N2的体积,可导致实际测得氮气的体积偏大,如果装置漏气,不能测出氮气的体积.
故答案为:(1)a、分液漏斗;b、铁架台;
(2)NaNO2+NH4Cl
NaCl+2H2O+N2↑;△ .
(3)检查气密性;
(4)因为反应放热,防止水准管中水冲出,影响实验(必须写出关键词“反应放热”);
(5)易溶;27%;88毫升;
(6)100mL;
(7)A.
