问题
问答题
在生产和生活中,金属腐蚀所带来的损失非常严重,所以防止金属腐蚀已成为科学研究和技术领域的重大问题。化学兴趣小组的同学在实验室中对金属的腐蚀进行了探究。
【活动与探究一】 分别在三个洁净干燥的试管中各加一个洁净无锈的铁钉,再在其中两个试管中加入经煮沸迅速冷却的蒸馏水,其它操作请仔细观察下图:
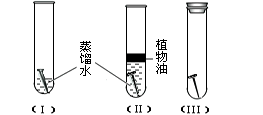
(1)探究结论:____号试管中的铁钉最容易生锈。由此可见,铁制品生锈需要的条件是__________。
【活动与探究二】 向铁粉中加入少量的炭粉(模拟铁钉的成分),混合均匀后,撒入内壁分别用稀盐酸和氯化钠溶液润湿过的两只试管(分别标记为a、b),按下图装好仪器。几分钟后,打开止水夹,观察发现:a装置右侧小试管中液面上升,导管中液面下降;而b装置右侧小试管中液面下降,导管中液面上升;b装置固体混合物中发现有红色物质生成。
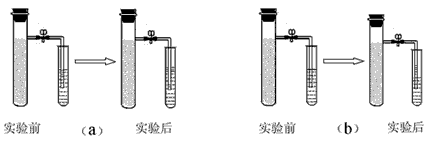
(2)请你推测:a装置右侧小试管中液面上升的原因是___________;b装置右侧小试管中液面下降的原因是______________。
(3)将“活动与探究一”中已生锈的铁钉放入稀盐酸中,可观察到__________、_________,化学方程式为________________________________。
答案
(1)Ⅰ;铁与空气中的氧气、水蒸气接触;
(2)铁与盐酸反应生成氢气,左侧试管中气体增加; 氧气与铁反应,左侧试管中气体减少;
(3)铁锈溶解,溶液成黄色,溶液呈浅绿色,有气泡生成(只要答出其中任意2点即可);
Fe2O3 +6HCl == 2FeCl3 +3H2O 或Fe +2HCl == FeCl2 +H2↑
