利用食盐和氨气及二氧化碳生产纯碱的“联合制碱法”是由我国著名化学家侯德傍先生发明的.生产的关键是在沉淀池中让原料尽可能多地转化成NaHCO3固体(因溶解度小而结晶成固体沉淀物)和主要含NH4Cl的母液,主要生产流程如下:(已知:铵盐能与碱反应产生NH3)
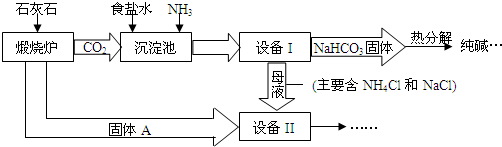
(1)“煅烧炉”中发生反应的化学方程式是______.
(2)若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是______.
(3)在“设备(Ⅱ)”中固体A与水反应的化学方程式是______.
(4)母液在“设备(Ⅱ)”中经处理后的生成物中,除水以外可在本流程中再利用的物质有______(填写化学式).
(5)NaHCO3固体热分解生成纯碱的反应方程式为:______.
(6)请写出一个该生产流程的一个优点:______.
(1)碳酸钙在高温下分解生成二氧化碳气体和氧化钙,化学方程式为:CaCO3
CaO+CO2↑;高温 .
(2)过滤是把不溶于液体的固体和液体分开的一种分离混合物的方法,“设备(I)”中的液体混合物中分离出析出的晶体,故可用过滤的方法;
(3)氧化钙与水反应生成氢氧化钙,化学方程式为:H2O+CaO=Ca(OH)2;
(4)进入“设备(Ⅱ)”的物质有氧化钙、氯化钠、氯化铵及水,发生的反应有H2O+CaO=Ca(OH)2、Ca(OH)2+2NH4Cl=2NH3↑+2H2O+CaCl2,最终产物有氯化钠、氯化钙、氨气,其中氯化钠、氨气可再利用;
(5)NaHCO3固体热分解生成纯碱的反应的化学方程式为:2NaHCO3
Na2CO3+CO2↑+2H2O;△ .
(6)从生产过程流程图可看出,使用的原料成本低、易得,且生产流程中有些物质可循环利用原料便宜易得(或者有物质可以循环利用)
故答案为:
(1)CaCO3
CaO+CO2↑;高温 .
(2)过滤;漏斗、玻璃棒;
(3)H2O+CaO=Ca(OH)2;
(4)NH3、NaCl;
(5)2NaHCO3
Na2CO3+CO2↑+2H2O△ .
(6)原料便宜易得(或者有物质可以循环利用)
