问题
推断题
如下图转化关系中,常温下E、F、L、I为无色气体,F是形成酸雨的主要原因之一,D为无色液体,M是淡黄色固体,在E的水溶液中通入过量的F得到A。

试回答下列问题:
(1)A的晶体中含有的化学键为__________;B的电子式为____________。
(2)写出D→B的化学反应方程式 ______________________, 7.8g M与足量的D充分反应时转移电子的数目为_________。
(3)写出E与H反应生成的正盐溶液中的离子浓度大小关系____________。
(4)E作为燃料电池燃气时,发生的总反应为:E+O2 → N2+H2O,KOH溶液为电解质溶液,负极反应式是____________。
(5)Zn与K的稀溶液反应,当有1mol K参与反应时,有0.8mol电子转移,此时K的还原产物可能是_______________。
(6)将少量的F通入NaClO溶液中,其离子反应方程式为___________。
答案
(1)离子键、共价键、配位键;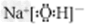
(2)2Na2O2+2H2O=4NaOH+O2↑;6.02×1022 或0.1NA
(3)c(NH4+)>c(SO42-)>c(H+)>c(OH-)
(4)4NH3-12e-+12OH-=2N2+12H2O或2NH3-6e-+6OH-=N2+6H2O
(5)N2O、NH4NO3
(6)SO2+3ClO-+H2O=SO42-+Cl-+2HClO
