已知水在25℃和95℃时,其电离平衡曲线如图所示:
(1)则95℃时,水的电离平衡曲线应为______(填“A”或“B”),请说明理由______.
(2)25℃时,将①H+、②Cl-、③Al3+、④K+、⑤S2-、
⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,基本上不影响水的电离平衡的是______.(填入相应序号)
(3)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是______.
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5.请分析其原因:______.
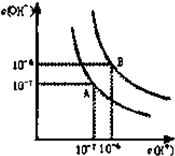
(1)水的电离是吸热过程,升高温度,使水的电离程度增大,当温度升高时,促进水的电离,水的离子积增大,水中氢离子、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性,则95℃时,水的电离平衡曲线应B;
故答案为:B;水的电离是吸热过程,温度高时,电离程度大,c(H+)、c(OH-)大;
(2)25℃时,将①H+、②Cl-、③Al3+、④K+、⑤S2-、⑥OH-、⑦NO3-、⑧NH4+分别加入H2O中,①抑制水的电离,②氯离子不允许水的电离平衡,③Al3+水解显酸性,促进水的电离,④K+对水的电离无影响,⑤S2-、水解显碱性,对水的电离起到促进,⑥碱抑制水的电离,⑦NO3-离子对水的电离无影响,⑧NH4+离子水解溶液呈酸性,促进水的电离,所以基本上不影响水的电离平衡的是②④⑦;
故答案为:②④⑦;
(3)若100体积pH1=a的某强酸溶液中氢离子的物质的量浓度=10-a mol/L,1体积pH2=b的某强碱溶液中氢氧根离子的物质的量浓度=10 b-12 mol/L,混合后溶液呈中性,则氢离子的物质的量等于氢氧根离子的物质的量,所以100×10-a mol/L=1×10 b-12 mol/L,所以a+b=14(或pH1+pH2═14)
故答案为:a+b=14(或pH1+pH2═14);
(4)曲线B对应95℃,pH=2的某酸HA中氢离子浓度与pH=10的NaOH溶液中氢氧根离子浓度相等,HA若为强酸,完全反应后pH=6,实际上pH=5,说明酸过量,则该酸为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,导致溶液中氢离子浓度大于氢氧根离子浓度而使溶液呈酸性;
故答案为:曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5;
