现有A、B、C、D四种物质,B、D的焰色反应均为黄色。C是一种强酸的酸式盐,将C加入BaCl2溶液有不溶于盐酸的 白色沉淀生成,D晶体在于燥空气中容易失去结晶水变成白色粉末。对A、B、C、D进行下列实验,实验过程和记录如图所示(无关物质已略去),请回答:
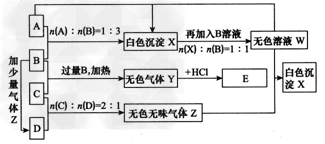
(1)将A溶液蒸干并灼烧得到的固体是___(写化学式)。
(2)Y的电子式是____,Z的结构式是____。
(3)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序为____。
(4)有人设想在适当大小的管道中填充一定量的D的晶体(相对分子质量在280~300之间),管道环绕在一个房子的周围, 这样的房子白天和晚上室内温度可保持相对恒定,请简述其原理:____ 。
(5)写出过量的Z与W反应生成X的化学方程式:____。
(6)写出C与过量B反应(加热)的离子方程式:____。
(1) Al2O3
(2)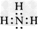 ;O=C=O
;O=C=O
(3)c(Na+)>c(SO42- )>c(NH4+)>c(H+)=c(OH-)
(4)白天有太阳,Na2CO3·10H2O分解吸热,晚上H2O和Na2CO3再结合成晶体放热,可以调节温度
(5)CO2+NaAlO2+2H2O=Al(OH)3↓+NaHCO3
(6) NH4++H++2OH-  NH3↑+2H2O
NH3↑+2H2O
