已知A、B、D为中学常见的气体单质,甲、乙、丙、丁为常见的化合物,甲的水溶液呈碱性.它们之间有如下所示转化关系(部分产物及反应条件已略去)
请完成下列空白:
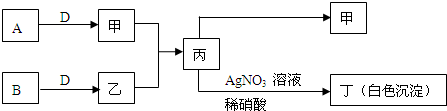
(1)乙的名称为______,丙转化为丁的离子方程式为______
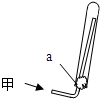
(2)实验室可通过多种方法制备甲,用如图所示装置收集甲,下列关于制取及收集甲实验的叙述中,正确的是______(填序号)
①甲气体不能用排水法收集
②实验室用丙一种药品可以制取甲
③图中的a为浸有稀H2SO4的棉花
④可用甲的浓溶液和生石灰为原料制取甲
(3)工业上通常以甲为原料制备HNO3.硝酸工业尾气中的NO和NO2对环境有污染,可用NaOH溶液吸收.尾气中NO与NO2按物质的量之比1:1被NaOH溶液吸收得到一种钠盐,该反应的化学方程式为______.
甲是由A、D气体单质形成的化合物,水溶液呈碱性,应为NH3,丙中加入硝酸银生成白色沉淀,该沉淀不溶于硝酸,应为AgCl,则丙为NH4Cl,由此可知乙为HCl,则A为N2,B为Cl2,D为H2,
(1)由以上分析可知乙为氯化氢,丙为氯化铵,与硝酸酸化的硝酸银发生:Ag++Cl-=AgCl↓,
故答案为:氯化氢;Ag++Cl-=AgCl↓;
(2)①甲气体极易溶于水,不能用排水法收集,故①正确;
②氯化铵加热易分解,但生成的氨气和氯化氢和重新生成氯化铵,不能用加热氯化铵的方法制备氨气,应用氯化铵和氢氧化钙固体制备,故②错误;
③氨气易与酸反应,用干燥的棉花的密度是防止氨气逸散和与空气对流,但不能用浸有稀H2SO4的棉花,故③错误;
④生石灰可与水反应,丙放热,可促进氨气的挥发,则可用氨气的浓溶液和生石灰为原料制取氨气,故④正确,
故答案为:①④;
(3)发生反应为归中反应,根据N元素的化合价可知应生成NaNO2,反应的方程式为NO+NO2+2NaOH=2NaNO2+H2O,
故答案为:NO+NO2+2NaOH=2NaNO2+H2O.
