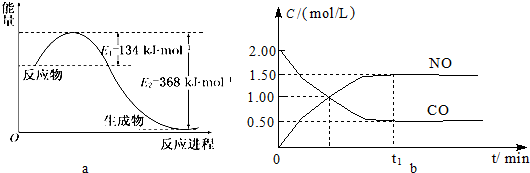
图a是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,图b是反应中的CO和NO的浓度随时间变化的示意图.根据图意回答下列问题:
(1)写出NO2和CO反应的热化学方程式______.
(2)从反应开始到平衡,用NO2浓度变化表示平均反应速率v(NO2)=______.
(3)此温度下该反应的平衡常数K=______;温度降低,K______(填“变大”、“变小”或“不变”)
(4)若在温度和容积相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol NO2 1mol CO | 2mol NO 2mol CO2 | 1mol NO2、1mol CO 1mol NO、1mol CO2 |
| 平衡时c(NO)/mol•L-1 | 1.5 | 3 | m |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| CO或NO的转化率 | α1 | α2 | α3 |
| b |
| 2 |
(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ•mol-1;
(2)由图可知,t1min到达平衡,平衡时NO的浓度变化量为1.5mol/L,故v(NO)=
=1.5mol/L t1min
mol•L-1•min-1,速率之比等于化学计量数之比,故v(NO2)=v(NO)=1.5 t1
mol•L-1•min-1,1.5 t1
故答案为:
mol•L-1•min-1;1.5 t1
(3)CO的起始浓度为2mol/L,二氧化氮与NO的起始物质的量相等,故NO2的起始浓度为2mol/L,平衡时NO的浓度变化量为1.5mol/L,则:
NO2(g)+CO(g)=CO2(g)+NO(g)
开始(mol/L):2 2 0 0
变化(mol/L):1.5 1.5 1.5 1.5
平衡(mol/L):0.5 0.5 1.5 1.5
故该温度下平衡常数k=
=9,1.5×1.5 0.5×0.5
该反应正反应是放热反应,降低温度平衡向正反应方向移动,平衡常数变大,
故答案为:9:变大;
(4)甲与乙是等效平衡,对应各组分的含量完全相同,对应各组分的物质的量乙是甲中的2倍,CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时NO的转化率为α2,乙中平衡时CO的物质的量为2α2mol,故2(1-α1)=2α2,整理得α1+α2=1;
令平衡时甲中CO为nmol,则乙中CO为2nmol,甲中放出的热量为(1-n)×234kJ=akJ,乙中吸收的热量为2n×234kJ=bkJ,整理得a+
=234;b 2
丙与乙是完全等效平衡,平衡时NO的浓度相等,故m=3mol/L,
故答案为:1;234;3mol/L.
