A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示.
(1)若A是淡黄色化合物;D是CO2;C为NaOH.
①写出A的电子式______
②写出反应Ⅱ的化学方程式______
(2)若A是地壳中含量最多的金属元素的单质,B在火焰上灼烧时火焰呈黄色,E是一种无色无味的气体,遇澄清的石灰水变浑浊.
①写出B的化学式______②写出反应Ⅲ的离子方程式______
③用单线桥法表示反应Ⅰ电子转移的方向和数目______.
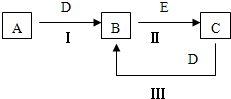
(1)若A是淡黄色化合物;D是CO2;C为NaOH,由转化关系A
B,CO2+NaOH→B,故B为Na2CO3,A为Na2O2,由Na2CO3CO2
NaOH可知,E为Ca(OH)2或Ba(OH)2,符合转化关系;E
①A为Na2O2,由钠离子与过氧根离子构成,电子式为:
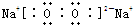
,故答案为:
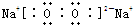
;
②反应Ⅱ是氢氧化钙[或Ba(OH)2)]与碳酸钠反应生成碳酸钙(或碳酸钡)与氢氧化钠,反应化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH[或Na2CO3+Ba(OH)2=BaCO3↓+2NaOH],
故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH[或Na2CO3+Ba(OH)2=BaCO3↓+2NaOH];
(2)若A是地壳中含量最多的金属元素的单质,A为金属Al,B在火焰上灼烧时火焰呈黄色,B含有Na元素,由Al
B可知,D为NaOH,B为NaAlO2,E是一种无色无味的气体,遇澄清的石灰水变浑浊,E为CO2,由NaAlO2D
CCO2
B,C为Al(OH)3,NaOH
①有上述分析可知,B为NaAlO2,故答案为:NaAlO2;
②反应Ⅲ是氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
③反应Ⅰ为2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑,反应中转移电子数目为6,用单线桥法表示电子转移的方向和数目为
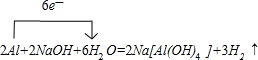
,
故答案为:
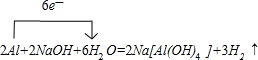
.
