如图所示各物质的相互转变中,A是由原子个数比为1:2:4的三种元素组成的化合物,其中某元素的质量分数为50%,J、K是日常食品中的调味剂,J为有机物,相对分子质量为60;常温下,C、D、F、H是气体,E、I是固体单质;反应③④⑤⑥均是工业生产中的重要反应.(反应⑥中生成的水已略去)
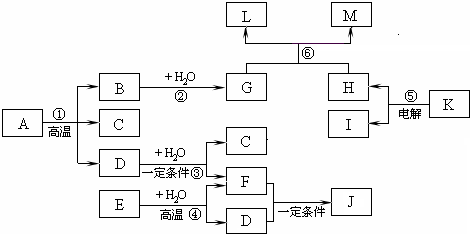
请回答下列问题:
(1)写出K的化学式:______;J的结构简式:______.
(2)写出反应①的化学方程式:______.
(3)写出反应⑥的化学方程式:______.
(4)D和F反应生成J,符合绿色化学思想的原因是______.
J、K是日常食品中的调味剂,J为有机物,相对分子质量为60,故J为CH3COOH,由转化关系K
H+I,故K为NaCl,H是气体,I是固体单质,故H为Cl2,I为金属Na;电解
反应⑥是工业生产重要反应,有氯气参加反应,生成三种物质,其中一种是水,考虑漂白粉的制备,物质G可能为Ca(OH)2,B应是CaO;
由转化关系F+D→CH3COOH,可知F与D中共含有C、H、O三种元素,由转化反应④可知,固体E为C单质,故反应④为C+H2O
CO+H2,由反应③可知,D能与水反应,故D为CO,F为H2,C为CO2; 高温 .
由反应①可知,A反应生成CaO、CO、CO2,A中含有Ca、C、O三种元素,A不可能是碳酸钙,考虑有机酸的钙盐,A中原子个数比为1:2:4,A可能是CaC2O4,其中O元素的质量分数为50%,符合题意.
(1)由上述分析可知,K为NaCl,J为CH3COOH,故答案为:NaCl;CH3COOH;
(2)反应①是CaC2O4分解生成CaO、CO2、CO,反应方程式为CaC2O4
CaO+CO2↑+CO↑, 高温 .
故答案为:CaC2O4
CaO+CO2↑+CO↑; 高温 .
(3)反应⑥是氯气与氢氧化钙反应生成氯化钙、次氯酸根与水,反应方程式为:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,
故答案为:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;
(4)D和F反应生成J的反应为2CO+2H2
CH3COOH,原子的利用率为100%,符合绿色化学思想,故答案为:原子的利用率为100%.一定条件
