A、B、C、D分别代表硝酸银、偏铝酸钠、稀盐酸、浓氨水四种无色溶液中的一种.甲、乙两同学按不同体积比进行了两两混合,实验现象如下:
(1)根据图中A、C各能溶解一种沉淀,可判断A、C两种物质可能是______和______.
(2)结合图中A、B混合无现象,可确定B是______,则A必然是______.
(3)写出A和D按物质的量之比为1:1混合时反应的离子方程式______.
(4)写出B和C按物质的量之比为1:1混合时反应的化学方程式______.
(5)甲同学做B、C反应实验时,n(B)/n(C)应符合的条件是______.
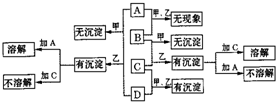
题给四种物质中,浓氨水与AgNO3(aq)混合,可能生成沉淀AgOH(会有部分分解为Ag2O),也可能生成无色[Ag(NH3)2]+(aq);NaAlO2(aq)与HCl(aq)混合,可能生成Al(OH)3沉淀,也可能生成无色AlCl3(aq).Al(OH)3沉淀溶于HCl(aq),但不溶于氨水;AgOH(含Ag2O)沉淀溶于氨水,但在HCl(aq)中沉淀并不消失.这样,可知B、D为NaAlO2(aq)和AgNO3(aq),B遇A(氨水或稀盐酸)无现象,则B为NaAlO2,A为氨水,C为稀盐酸,D为AgNO3.
(1)由以上分析可知生成的沉淀可为AgOH、AgCl或Al(OH)3,能溶解AgOH、AgCl的为浓氨水,能溶解的Al(OH)3为盐酸,由转化关系可知A为浓氨水,C为盐酸,
故答案为:浓氨水;盐酸;
(2)由以上分析可知B为NaAlO2,A为浓氨水,故答案为:NaAlO2;浓氨水;
(3)氨水和AgNO3按物质的量之比为1:1混合时反应的离子方程式为Ag++NH3?H2O=Ag0H↓+NH4+,
故答案为:Ag++NH3?H2O=Ag0H↓+NH4+;
(4)NaAlO2和稀盐酸按物质的量之比为1:1混合时反应的化学方程式为NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,
NaAlO2+HCl+H2O=Al(OH)3↓+NaCl;
(5)B为NaAlO2,C为稀盐酸,甲同学做B、C反应实验时,没有沉淀生成,发生NaAlO2+4HCl=AlCl3+NaCl+2H2O,则n(B)/n(C)应符合的条件是≤
,1 4
故答案为:≤
.1 4
