A、B、C是单质,其中A是金属,各种物质间的转化关系如图:根据图示转化关系回答:
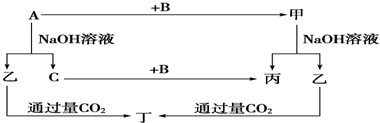
(1)写出下列物质的化学式.A______,B______,乙______,丁______.
(2)写出下列变化的化学方程式.
①A与NaOH溶液反应的化学方程式______.②甲与NaOH溶液反应的离子方程式______.
(3)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36L,则消耗的A的物质的量为______,转移电子数目为______.
常见金属单质中能与NaOH溶液反应产生气体的只有Al,所以A是Al,乙是NaAlO2,C是H2,甲是Al的化合物,可和NaOH溶液反应产生NaAlO2,甲可能是Al2O3,则丙是H2O,B即是O2,根据NaAlO2+CO2+2H2O═NaHCO3+Al(OH)3↓得丁是Al(OH)3,则:
(1)由上述分析可知,A为Al,B为O2,乙是NaAlO2,丁是Al(OH)3;
故答案为:Al,O2,NaAlO2,Al(OH)3;
(2)①Al与NaOH溶液反应生成偏铝酸钠与氢气,反应方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
②Al2O3与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-═2AlO2-+H2O;
故答案为:Al2O3+2OH-═2AlO2-+H2O;
(3)产生的H2在标准状况下的体积为3.36L,物质的量为
=0.15mol,根据2Al+2NaOH+2H2O═2NaAlO2+3H2↑可知,消耗的Al的物质的量为0.15mol×3.36L 22.4L/mol
=0.1mol,转移电子数目为0.1mol×3×NAmol-1=0.3NA;2 3
故答案为:0.1mol,0.3NA.
