如图为一些常见无机物之间的转化关系,已知X是-种盐,H是金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.试回答下列问题:
(1)G的化学式为:______.在反应①中,每生成2.24L(标准状况下)气体F,反应转移电子的物质的量为______.
(2)写出下列反应的化学方程式
①______;②______.
(3)X在医药上用作解酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸的物质的量之比为3:8,则X的化学式为______;X与盐酸反应的化学方程式为______.
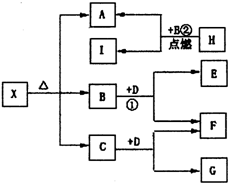
H是金属单质,在B中点燃反应生成A、I,I是常见非金属单质,推断为:H为Mg,I为C,A为MgO,B为CO2;B+D=E+F,F为非金属单质,E为工业上重要的碱性物质,推断为:D为Na2O2,E为Na2CO3,F为O2,G是工业上重要的碱性物质,C+Na2O2=G+O2;可以判断:G为NaOH,C为H2O;
(1)G的化学式为:NaOH,反应①发生的反应是2Na2O2+2CO2=2Na2CO3+O2,每生成1molO2,电子转移为2e-,每生成2.24L(标准状况下)气体F(O2)物质的量为0.1mol,反应转移电子的物质的量为0.2mol,故答案为:NaOH;0.2mol;
(2)反应①的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2;②的化学方程式为:2Mg+CO2
2MgO+C, 点燃 .
故答案为:2Na2O2+2CO2=2Na2CO3+O2;2Mg+CO2
2MgO+C; 点燃 .
(3)X在医药上用作解酸剂,X为镁的碳酸盐,与盐酸作用时,生成B(CO2)的物质的量与消耗盐酸的物质的量之比为3:8,生成产物氯化镁二氧化碳和水,依据反应中原子守恒和反应性质可知,1molX中含碳酸根离子为3mol,含镁离子4mol,依据化合价代数和为0和原子守恒得到X的化学式为Mg4(OH)2(CO3)3或Mg(OH)2•3MgCO3;
与盐酸反应的化学方程式:Mg4(OH)2(CO3)3+8HCl=4MgCl2+3CO2↑+5H2O,
故答案为:Mg4(OH)2(CO3)3+8HCl=4MgCl2+3CO2↑+5H2O.

