已知A、B、D、E四种物质中均含有同一种短周期元素,该元素原子的最外层电子数是内层电子数的3倍,D为气体单质,E为黑色粉末.如图转化关系中E均起催化作用(某些产物已略去).
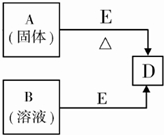
则:
(1)A的化学式为______;B分子的电子式为______;
(2)已知E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X.甲同学为探究该气体的性质,设计了如图装置(III中夹持装置已略去).
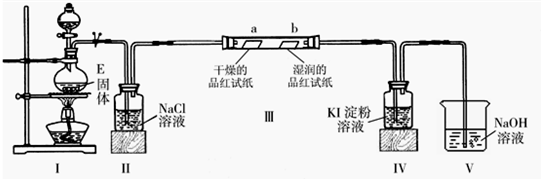
①I中发生反应的离子方程式为______;
②实验开始不久,观察到装置IV中的现象为______;
③实验结束后,该同学在装置III中观察到b的红色褪去,而没有出现“a无明显现象”这一预期现象.为达到实验目的,他在装置______(填装置序号)之间又添加了洗气瓶,该装置的作用是______;
(3)将气体X通入到紫色的石蕊试液中,观察到的现象是______;
(4)气体X能与溶液B反应,生成气体D,试写出该反应的化学方程式:______.
已知A、B、D、E四种物质中均含有同一种短周期元素,该元素原子的最外层电子数是内层电子数的3倍,应为O元素,D为气体单质,应为O2,E为黑色粉末,应为MnO2,根据物质的状态和反应条件下可知A为KClO3,B为H2O2,都可在MnO2作用下生成氧气,E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X,应为MnO2与浓盐酸的反应,生成X为Cl2,
(1)由以上分析可知A为KClO3,B为H2O2,电子式为
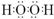
,故答案为:KClO3;
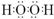
;
(2)①Ⅰ为制取氯气的发生装置,反应的方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O, △ .
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O; △ .
②氯气具有氧化性,与KI反应生成碘单质,淀粉遇碘变蓝色,故答案为:溶液变蓝;
③为验证干燥的氯气不具有漂白性,则通入Ⅲ中的氯气应为干燥后的氯气,应装置II和III添加盛有浓硫酸的洗气装置,用以除去氯气中的水蒸气,
故答案为:装置II和III;除去氯气中的水蒸气(或:干燥氯气);
(3)氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,可使紫色的石蕊试液先变红后褪色,故答案为:紫色的石蕊试液先变红后褪色;
(4)气体Cl2能与溶液H2O2反应,生成气体O2,该反应的方程式为Cl2+H2O2=2HCl+O2,故答案为:Cl2+H2O2=2HCl+O2.
