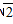A、B、C、D、E均为可溶于水的固体,组成它们的离子有
| 阳离子 | Na+、Mg2+、Al3+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、SO42-、HSO4- |
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失.据此推断它们是
A______;B______;C______;D______.
依据阴阳离子共存的分析判断,阴离子CO32- 只能和Na+结合为Na2CO3;OH-只能和 Ba2+结合为溶于水的Ba(OH)2;所以分析可知离子间 SO42-和Al3+ 结合成的物质为Al2(SO4)3;最后剩余Cl- 和HSO-4结合的阳离子Na+、Mg2+;依据反应现象可知A和BCD都生成沉淀且沉淀都溶于酸溶液,分析离子性质判断A为Na2CO3;E为含HSO4-,沉淀可以是Mg2+ Al3+ Ba2+的碳酸盐沉淀;BCD物质中分别含这三种阳离子,依据④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失,说明溶解的沉淀是Al(OH)3;结合离子性质和物质组成判断B为Al2(SO4)3,D为Ba(OH)2,C为MgCl2,符合①②③沉淀形成的性质;①②生成的沉淀溶解于E,说明E中不能含和硫酸根离子、镁离子生成沉淀的离子,则E只能为:NaHSO4(或Mg(HSO4)2);推断出A:Na2CO3 B:Al2(SO4)3 C:MgCl2 D:Ba(OH)2 A:Na2CO3 B:Al2(SO4)3 C:MgCl2 D:Ba(OH)2 E:NaHSO4(或Mg(HSO4)2);
故答案为:A:Na2CO3 B:Al2(SO4)3 C:MgCl2 D:Ba(OH)2 A:Na2CO3 B:Al2(SO4)3 C:MgCl2 D:Ba(OH)2 E:NaHSO4(或Mg(HSO4)2);