下图所示反应Ⅰ、反应Ⅱ和反应Ⅲ均是工业生产中常见的反应.其中A、B为化合物,C是温室气体之一,D和K均可用做干燥剂,H常温下为液态化合物,J是一种具有漂白作用的盐,反应Ⅲ和E与G反应的原理相同.
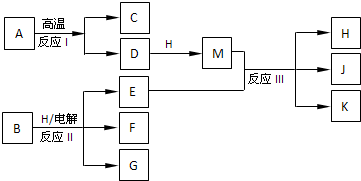
(1)C的化学式是______;组成单质F的元素在周期表中的位置是______;M中存在的化学键类型为______.
(2)C与J的水溶液反应后生成的含氧酸的电子式是______.
(3)E与G反应的离子方程式是______.
(4)J久置后,即便不接触水、空气,本身也逐渐分解生成K,并放出气体,该反应的化学方程式是______.
(5)工业上测定反应Ⅲ产品的有效成分J的含量,先将一定量产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果.
①用Na2S2O3标准溶液滴定I2时选用的指示剂是______.
②生成I2的反应的离子方程式是______.
反应I、反应II和反应III均是工业生产中常见的反应,A、B为化合物,C是温室气体之一为CO2,D和K均可用做干燥剂结合反应条件判断为D为CaO,A为CaCO3,H常温下为液态化合物推断为H2O,M为Ca(OH)2,J是一种具有漂白作用的盐推断为Ca(ClO)2,K为CaCl2,E为Cl2,反应III和E与G反应的原理相同,说明G为碱,结合反应条件,可以推断B为NaCl,电解溶液反应生成产物G为NaOH,F为H2;
(1)C为CO2 ,组成单质F的元素是氢元素,在周期表中的位置第一周期,第ⅠA族,分析推断M为Ca(OH)2,存在的化学键类型为离子键,共价键,
故答案为:CO2;第一周期,第ⅠA族;离子键,共价键;
(2)C与J的水溶液反应为CO2+H2O+Ca(ClO)2=CaCO3↓+2HClO,反应后生成的含氧酸为HClO,次氯酸的电子式是:
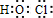
,故答案为:
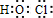
;
(3)E与G反应是氯气和氢氧化钠溶液的反应生成氯化钠次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)J(Ca(ClO)2)久置后,即便不接触水、空气,本身也逐渐分解生成K(CaCl2),并放出气体氧气,该反应的化学方程式:Ca(ClO)2=CaCl2+O2↑,
故答案为:Ca(ClO)2=CaCl2+O2↑;
(5)①碘单质遇淀粉溶液变蓝;用Na2S2O3标准溶液滴定I2时选用的指示剂为淀粉,随着Na2S2O3标准溶液的滴入,蓝色褪去,故答案为:淀粉溶液;
②生成I2的反应的离子方程式为:ClO-+2I-+2H+=Cl-+I2+H2O,故答案为:ClO-+2I-+2H+=Cl-+I2+H2O.
