在一定条件下可实现图所示物质之间的变化:
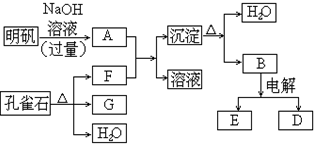
请填写以下空白:
(1)孔雀石的主要成分是Cu2(OH)2CO3,受热易分解,如图中的F是(写化学式)______.其相应的电子式是______.
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:______.
(3)图中所得G和D都为固体,混合后在高温下可发生反应,写出该反应的反应方程式:______.
(4)每生成1个D,同时生成______个E.
(5)D与NaOH溶液反应的化学反应方程式为(用单桥式标出电子转移的方向及数目)______.
根据不活泼金属碳酸盐受热易分解成金属氧化物和CO2,以及不活泼金属的氢氧化物受热易分解成金属氧化物和H2O的规律,可推知孔雀石的分解产物为CuO、CO2和H2O,由题意知G为固体即CuO,则F为气体CO2.根据明矾的组成以及Al3+的性质可知A为含有NaAlO2的溶液,B为氢氧化铝受热分解的产物之一,为Al2O3,根据电解冶炼铝可以得到金属铝,推知D为Al,E为O2,用Al作还原剂可以还原CuO,
(1)由以上分析可知F为CO2,为共价化合物,电子式为
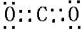
,故答案为:CO2;
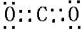
;
(2)明矾溶液与过量NaOH溶液反应的实质是:铝离子和氢氧根之间的反应,离子方程式为:Al3++4OH-=AlO2-+2H2O,
故答案为:Al3++4OH-=AlO2-+2H2O;
(3)G为氧化铜,B为氢氧化铝受热分解的产物之一,为氧化铝,电解产物为铝,铝和氧化铜高温下的反应为:3CuO+2Al
3Cu+Al2O3,故答案为:3CuO+2Al 高温 .
3Cu+Al2O3; 高温 .
(4)氧化铝电解的反应为:2Al2O3
4Al+3O2↑,属于氧化还原反应,图中所得G和D都为固体,所以D为铝,每生成1摩铝,同时生成 电解 .
mol的氧气,故答案为:3 4
;3 4
(5)Al和NaOH反应的方程式为2Al+2NaOH+6H2O=2NaAlO2+3H2↑+4H2O,反应中Al化合价由0价升高到+3价,每molAl失去3mol电子转移到H,则电子转移的方向和数目为
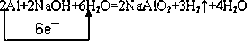
,
故答案为:
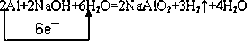
.
