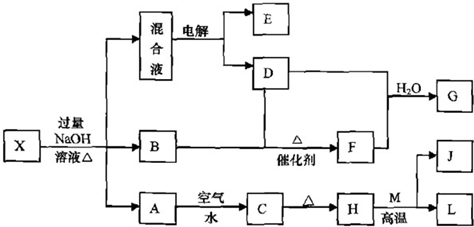
有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物已略).其中,B、D、E、F均为无色气体,M、L为日常生活中常见的两种金属单质,其中L的组成元素的原子序数是M的组成元素的原子序数的2倍,H和M反应可放出大量的热.在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀.
请回答下列问题:
(1)化合物B的电子式为______,H和M反应的一个应用______.
(2)若L的组成元素的原子最外层有2个电子,写出L的组成元素的原子结构示意图______.
(3)物质X的水溶液中各离子浓度的大小顺序是______.
(4)简述A到C的实验现象______.
(5)①写出D与F反应生成G的化学方程式______.
②写出X与过量的NaOH溶液反应的离子方程式______.
(6)已知a g E气体在D中完全燃烧生成稳定的化合物时,放出bKJ的热量,写出E燃烧热的热化学方程式______.
有一化合物X,其水溶液为浅绿色,说明X含有亚铁离子,M、L为日常生活中常见的两种金属单质,其中L的组成元素的原子序数是M的组成元素的原子序数的2倍,所以L是铁,M是铝,H和M发生铝热反应,根据元素守恒知,H是氧化铁,J是氧化铝,亚铁离子和氢氧根离子反应生成氢氧化铁沉淀,氢氧化亚铁被氧化生成氢氧化铁,加热时,氢氧化铁分解生成氧化铁,所以A是氢氧化亚铁,B是氢氧化铁;
在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,说明混合溶液中含有硫酸根离子,混合溶液中还含有钠离子,所以电解混合溶液时,阴阳极上分别生成氢气、氧气,无色气体B和无色气体D生成无色气体F,且F能和D反应,则D是氧气,E是氢气,加热时,X能和氢氧化钠溶液反应生成气体,则X中含有铵根离子,所以B是氨气,则F是一氧化氮,一氧化氮、氧气和水反应生成硝酸G.
(1)通过以上分析知,B是氨气,其电子式为:
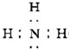
,H和M反应生成铁和氧化铝,且可放出大量的热,从而能焊接钢轨,故答案为:
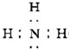
;焊接钢轨;
(2)通过以上分析知,L是铁元素,L的组成元素的原子最外层有2个电子,根据核外电子排布规则知,第一电子层上排2个电子,第二电子层上排8个电子,第三电子层上排14个电子,最外电子层上排2个电子,所以铁元素的原子结构示意图为:
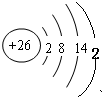
,故答案为:

;
(3)通过以上分析知,X的溶液中含有的离子是亚铁离子、铵根离子、硫酸根离子,根据电荷守恒知,化合物X中亚铁离子、铵根离子和硫酸根离子的个数比为1:2:2,X溶于水后,亚铁离子和铵根离子水解,但水解较微弱,硫酸根离子不水解,所以溶液呈酸性,即c(H+)>c(OH-),所以离子浓度大小顺序是c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-),故答案为:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-);
(4)亚铁离子和氢氧根离子反应生成白色的氢氧化亚铁沉淀,会迅速变成灰绿色沉淀,氢氧化亚铁不稳定,易被氧气氧化生成红褐色沉淀氢氧化铁,所以看到的现象是白色沉淀迅速变成灰绿色,最后变成红褐色,
故答案为:白色沉淀迅速变成灰绿色,最后变成红褐色;
(5)一氧化氮不稳定,易被氧气氧化生成二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,所以一氧化氮、氧气和水反应方程式为:4NO+3O2+2H2O═4HNO3,铵根离子和氢氧根离子反应生成氨气和水,亚铁离子和氢氧根离子反应生成氢氧化铁,所以发生的离子反应方程式为:2NH4++Fe2++4OH-═Fe(OH)2+2NH3+2H2O,
故答案为:4NO+3O2+2H2O═4HNO3;2NH4++Fe2++4OH-═Fe(OH)2+2NH3+2H2O;
(6)agE的物质的量=
mol,a 2
molE完全燃烧放出bKJ的热量,则1molE完全燃烧放出a 2
kJ热量,所以其E燃烧热的热化学方程式为:H2(g)+2Fe2O3+8SO2O2(g)═H2O(1)△H=-2b a
kJ/mol,2b a
故答案为:H2(g)+2Fe2O3+8SO2O2(g)═H2O(1)△H=-
kJ/mol.2b a

 向底面间的距离
向底面间的距离