如图A~J均代表不同物质或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料,常温下H为无色液体.
根据图示回答问题:
(1)写出下列物质的化学式:B______,E______,I______,J______;
(2)反应①的离子方程式是______;
E→F的化学方程式是______;
(3)F与过量盐酸反应的离子方程式是______.
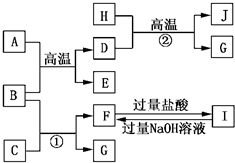
B是地壳中含量最高的金属元素,B为Al,由H+D
G+J,G是气体,J是磁性材料,常温下H为无色液体,该转化为Fe+H2O高温
Fe3O4+H2,故D为Fe,H为H2O,J为Fe3O4,G为H2,故A+B高温
D+E为铝热反应,A为Fe2O3,E为Al2O3;高温
由反应①Al+C→F+H2,C为酸或碱,F为铝盐后偏铝酸盐,由转化关系F
I可知,F为NaAlO2,I为AlCl3,故C为NaOH,过量盐酸 过量氢氧化钠
(1)由上述分析可知,B为Al,E为Al2O3,I为AlCl3,J为Fe3O4,故答案为:Al;Al2O3;AlCl3;Fe3O4;
(2)反应①是铝与氢氧化钠反应生成偏铝酸钠与氢气,反应离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
E→F的转化是氧化铝转化为偏铝酸钠,故应为氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应方程式为:Al2O3+2NaOH═2NaAlO2+H2O,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;Al2O3+2NaOH═2NaAlO2+H2O;
(3)NaAlO2与过量盐酸反应生成氯化铝与水,反应离子方程式为:AlO2-+4H+═Al3++2H2O,故答案为:AlO2-+4H+═Al3++2H2O.
