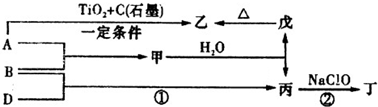
已知A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如下图所示(某些条件已略去).
请回答:
(1)单质B的组成元素在周期表中的位置是______.
(2)戊的化学式为______.戊与强碱反应的离子方程式:______.
(3)NaClO的电子式为______.
(4)甲与水反应的化学方程式为______.
(5)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:______.
(6)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知,该反应生成1mol乙时放出536kJ热量,其热化学方程式为:______.
A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体,则丙为NH3;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子,则丁为N2H4;戊是一种难溶于水的白色胶状物质,既能与强酸反应也能与强碱反应,具有净水作用,则戊为Al(OH)3;结合转化关系图可知,乙为氧化铝,A为Al;B为N2,甲为氮化铝,C为H2,
(1)组成B的元素为N元素,位于元素周期表中第2周期第ⅤA族,故答案为:第2周期第ⅤA族;
(2)由以上分析可知戊为Al(OH)3,为两性氢氧化物,可与强碱反应,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O;
(3)NaClO为离子化合物,电子式为
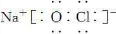
,故答案为:
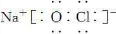
;
(4)甲为氮化铝,在水中发生水解生成NH3和Al(OH)3,反应的化学方程式为AlN+3H2O=Al(OH)3↓+NH3↑,
故答案为:AlN+3H2O=Al(OH)3↓+NH3↑;
(5)反应②为氨气与NaClO的反应,0.5molNaClO参加反应时,转移1mol电子,则Cl元素由+1价降低为-1价,该反应生成NaCl,同时生成N2H4和水,则该反应为2NH3+NaClO═N2H4+NaCl+H2O,故答案为:2NH3+NaClO═N2H4+NaCl+H2O;
(6)))-定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),即Al、TiO2、C反应生成Al2O3、TiC,生成1molAl2O3时放出536kJ热量,则生成2molAl2O3时放出536kJ×2=1072热量,所以热化学反应方程式为4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1072kJ/mol,
故答案为:4Al(s)+3TiO2(s)+3C(s)═2Al2O3(s)+3TiC(s)△H=-1072kJ/mol.
