已知X、Y、Z三元素的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.C、D是由X、Y、Z中两种元素组成的化合物,C通常状况下为无色液体,D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板.各物质之间的转换关系如下图,部分生成物省略.
请回答下列问题:
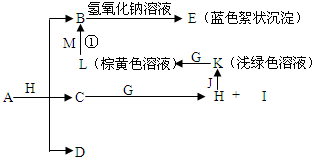
(1)写出A的化学式______,C的电子式______,D的结构式______.
(2)比较Y与Z的原子半径大小______>______(填写元素符号).
(3)写出反应K+G→L的离子方程式______.
(4)已知M溶于稀硝酸,溶液变成蓝色,并放出无色气体.请写出该反应的化学方程式______.
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称______、______、______.
G为黄绿色单质气体,所以G为Cl2;
C通常状况下为无色液体,与Cl2生成H和I,I有漂白作用,所以C为H2O,H为HCl,I为HClO;
HCl与金属J反应得到K,为淡绿色溶液,所以J为Fe,K为FeCl2,FeCl2与Cl2反应生成L,L为FeCl3;
E为蓝色絮状沉淀,则E为Cu(OH)2,FeCl3与金属M反应到B,B再与NaOH溶液反应到达Cu(OH)2沉淀,所以M为Cu,B为CuCl2;
在周期表中X的原子半径最小,X为H元素,C、D是由X、Y、Z中两种元素组成的化合物,C为H2O,所以Y、Z中两种元素有一种是O元素,Y、Z原子最外层电子数之和为10.所以另外元素的原子最外层电子数为4,D为无色非可燃性气体,所以D为CO2,由于X、Y、Z三元素的原子序数依次增大,故Y为O元素、Z为C元素.
(1)A与HCl反应生成CuCl2、H2O、CO2,所以A为Cu2(OH)2CO3或CuCO3,C为H2O,其电子式为
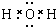
,D为CO2,其结构式为O=C=O,
故答案为:Cu2(OH)2CO3或CuCO3;
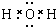
;O=C=O;
(2)Y为C元素、Z为O元素,同周期原子序数越大,原子半径越小,所以原子半径C>O,故答案为:C;O;
(3)氯气氧化亚铁离子为铁离子,自身被还原为氯离子,离子方程式为2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-;
(4)Cu溶于稀硝酸,溶液变成蓝色,并放出无色气体,说明生成Cu2+、NO等,反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(5)晶莹透明的晶体N,为碳单质,且为正四面体,故为金刚石,其同素异形体有石墨,富勒烯(C60),
故答案为:金刚石;石墨;富勒烯(C60).
