NaCl是一种化工原料,可以制备一系列物质(反应条件、部分反应物质已略去),它们的转化关系如图所示,请回答下列问题:
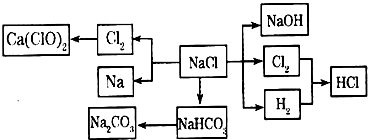
(1)工业上常用电解熔融NaCl的方法制取金属钠,NaCl熔化时破坏离子键的过程属于______(填“物理变化”或“化学变化”).
(2)写出工业上制取HCl的化学方程式______.
(3)写出工业上制取烧碱的离子方程式______.
(4)氨碱法制纯碱的工艺流程为:
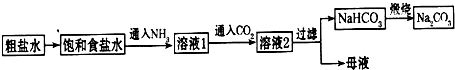
由NaHCO3制取Na2CO3的化学方程式______.工艺流程中无向饱和食盐水中通入NH3(再通入CO2)的目的是:______.
(5)请你设计一实验证明Na2CO3溶液碱性比NaHCO3溶液的碱性强:______.
(1)NaCl熔化的过程为物理过程,没有新物质生产,只存在离子键的断裂,没有生成新的化学键,属于物理变化,故答案为:物理变化;
(2)工业用氢气在氯气中燃烧的方法制备HCl,方程式为H2+Cl2
2HCl,故答案为:H2+Cl2 点燃 .
2HCl; 点燃 .
(3)工业用电解饱和食盐水的方法制备烧碱,反应的离子方程式为2Cl-+2H2O
2OH-+H2↑+Cl2↑, 通电 .
故答案为:2Cl-+2H2O
2OH-+H2↑+Cl2↑; 通电 .
(4)碳酸氢钠不稳定,加热分解生成碳酸钠,反应的化学方程式为2NaHCO3
Na2CO3+CO2↑+H2O,氨气极易溶于水,而二氧化碳微溶于水,先通入氨气,溶液呈碱性,再通入二氧化碳气体可之更多地转化为HCO3-, △ .
故答案为:2NaHCO3
Na2CO3+CO2↑+H2O;因为NH3极易溶于水且溶液呈弱减性,再通入CO2使之更多地转化为HCO3-; △ .
(5)碳酸钠和碳酸氢钠溶液都呈碱性,但二者水解水解程度不同,可用pH试纸测定,做法是配制 0.1mol•L-1(或等物质的量浓度)的两种溶液,则其pH,Na2CO3溶液pH大于NaHCO3溶液,说明Na2CO3溶液碱性比NaHCO3溶液的碱性强,
故答案为:配制 0.1mol•L-1(或等物质的量浓度)的两种溶液,则其pH,Na2CO3溶液pH大于NaHCO3溶液,说明Na2CO3溶液碱性比NaHCO3溶液的碱性强.
