已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略),请回答下列问题:
(1)请写出F的电子式______;在②反应中,当生成2.24L的G(标准状况)时,反应转移的电子数目为______
(2)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出稀溶液中①的离子方程式:______.
(3)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B分别为______.(写化学式)
(4)若A与B均为固体化合物,C是常见的一种中性干燥剂,则反应①的化学方程式为______;
若1.7g D与O2反应生成气态的产物时放出22.67kJ热量,写出该反应的热化学方程式:______.

E为常温下无色无味的液体且在生成物中,所以是水.F为淡黄色粉末,是过氧化钠或硫,但能和水反应,所以是过氧化钠.过氧化钠和水反应的生成物是氧气和氢氧化钠,G为常见的无色气体,所以G是氧气,H是氢氧化钠.
(1)F为过氧化钠,其电子式为
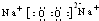
,
设该反应转移电子的物质的量xmol
2Na2O2+2H2O=4NaOH+O2↑ 转移电子数
22.4L 2mol
2.24L x
x=0.2mol,即数目为0.2NA或1.024×1023,
故答案为:
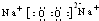
;0.2NA或1.024×1023;
(2)若A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,则A是氯气,与碱反应,生成盐酸盐、次氯酸盐和水,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)若C、D是两种均能使澄清的石灰水变浑浊的无色气体,即C、D是二氧化碳和二氧化硫,E为水,所以C、D、E是浓硫酸和碳反应的产物,故答案为:C、浓H2SO4;
(4)若A与B均为固体化合物,C是常见的一种中性干燥剂即氯化钙,所以A和B的反应可以是氯化铵和氢氧化钙生成氨气、氯化钙和水的反应,即2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑; △ .
根据热化学方程式的含义,1.7g即0.1mol氨气与O2反应生成气态的产物时放出22.67kJ热量,则4mol氨气与O2反应生成气态的产物时放出906.8KJ的热量,即热化学方程式为:
4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-906.8KJ/mol,
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑;4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-906.8KJ/mol. △ .
