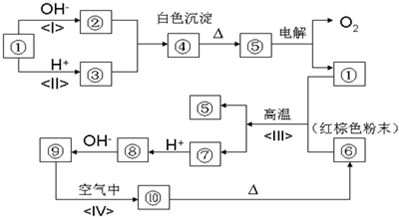
如图所示:①~⑩分别代表有关反应中的一种物质,它们均为常见物质.已知①~⑤和⑥~⑩中分别含有同一种元素.试回答下列问题:
(1)写出指定物质的化学式:④______;⑥______
(2)写出反应(Ⅲ)的化学方程式______指出该反应的重要用途之一:______
(3)写出反应(Ⅰ)的离子方程式______
(4)反应(Ⅳ)的主要实验现象是______该反应的化学方程式为:______.
①与强碱、强酸都反应,则①为铝或氧化铝或氢氧化铝或弱酸的铵盐等,②、③反应生成沉淀,则②是偏铝酸盐,③是铝盐,偏铝酸盐和铝盐反应生成白色沉淀氢氧化铝,则④是氢氧化铝,加热氢氧化铝生成氧化铝和水,①~⑤中含有同一种元素,所以⑤是氧化铝,电解氧化铝生成铝和氧气,所以①是铝;
红棕色粉末⑥是氧化铁,铝和⑦反应生成氧化铁和铝,根据铝热反应知,⑦是铁,铁和弱氧化性酸反应生成亚铁盐⑧,亚铁盐和氢氧根离子反应生成氢氧化亚铁⑨,氢氧化亚铁和氧气、水反应生成氢氧化铁⑩.
(1)通过以上分析知,④是Al(OH)3,⑥是Fe2O3;
故答案为:Al(OH)3,Fe2O3;
(2)铝和氧化铁发生铝热反应生成铁和氧化铝,反应方程式为:2Al+Fe2O3
2Fe+Al2O3,铝热反应可用于焊接钢轨; △ .
故答案为:2Al+Fe2O3
2Fe+Al2O3,焊接钢轨(或定向爆破) △ .
(3)铝和强碱溶液反应生成偏铝酸盐和氢气,
离子方程式为:2Al+2OH-+2H2O═AlO2-+3H2↑或2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑;
故答案为:2Al+2OH-+2H2O═AlO2-+3H2↑或2Al+2OH-+6H2O═2[Al(OH)4]-+3H2↑;
(4)氢氧化亚铁是白色沉淀,氢氧化亚铁不稳定,会迅速变成灰绿色,最终变成红褐色氢氧化铁沉淀,所以实验现象是:白色沉淀迅速变成灰绿色,最终变成红褐色,反应方程式为:4Fe(OH)2+O2+2H2O═4Fe(OH)3;
故答案为:白色沉淀迅速变成灰绿色,最终变成红褐色,4Fe(OH)2+O2+2H2O═4Fe(OH)3.
