A、B、C、D为中学化学常见的物质,它们间的反应关系如图所示.
(1)若A是可溶性强碱,B是正盐,D不溶于稀硝酸,则B的化学式______,有关反应的化学方程式为______.
(2)若B是正盐,D既可溶于盐酸又可溶于NaOH溶液.当A是NaHCO3时,该反应的离子方程式为______.
(3)若A是碳化钙(CaC2),A与B的溶液反应时只生成气体C、CaCO3和水;C的燃烧热为1300kJ•mol-1.则B的化学式为______;C燃烧的热化学方程式为______.
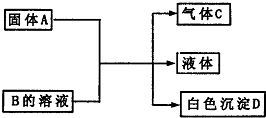
(1)强碱与铵盐共热放氨气,因A为强碱,所以B为铵盐,根据D不溶于稀硝酸,所以D为硫酸钡,故B为硫酸铵,A为氢氧化钡,二者反应方程式为:
Ba(OH)2+(NH4)SO4═BaSO4+2NH3↑+2H2O,
故答案为:(NH4)SO4;Ba(OH)2+(NH4)SO4═BaSO4+2NH3↑+2H2O;
(2)D既可溶于盐酸又可溶于NaOH溶液,可推知D为氢氧化铝沉淀,当A是NaHCO3时,B应含Al3+,二者发生双水解反应:
Al3++3HCO3-═Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-═Al(OH)3↓+3CO2↑;
(3)若A是碳化钙(CaC2),碳化钙(CaC2)与水反应生成氢氧化钙和乙炔气体(C),氢氧化钙和B反应生成碳酸钙和水,根据质量守恒可知B为碳酸氢钙,化学式为:Ca(HCO3)2,根据乙炔的燃烧热可写出乙炔燃烧的热化学方程式:
C2H2(g)+5/2O2 (g)═2CO2(g)+H2O(l)△H=-1300 KJ/mol.
故答案为:Ca(HCO3)2,C2H2(g)+5/2O2 (g)═2CO2(g)+H2O(l)△H=-1300 KJ/mol.
