现有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,B元素形成的一种化合物为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4g C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子.
(1)写出C的元素符号:C______;
(2)指出D在周期表的位置:______;
(3)B的最高价氧化物的水化物的电子式为______,所含的化学键类型为______;
(4)D的气态氢化物、H2S、HF的热稳定性由强到弱顺序是:______(用化学式表示).
现有A、B、C、D四种元素,A元素形成的-2价阴离子比氦原子的核外电子数多8个,则A为氧元素;B元素形成的一种化合物为淡黄色固体,该固体遇到空气能生成A的单质,则B为钠元素;C为原子核内有12个中子的金属元素,当2.4g C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子,令C的摩尔质量为xg/mol,则
×2=2.4 x
×2,解得x=24,所以C是质子数为24-12=12,故C为镁元素;D元素原子的M层上有7个电子,则D为氯元素.2.24 22.4
故A为氧元素;B为钠元素;C为镁元素;D为氯元素.
(1)由分析可知,C为Mg元素.
故答案为:Mg.
(2)D为氯元素,原子核外有17个电子,有3个电子层,最外层有7个电子,处于第三周期第ⅦA族.
故答案为:第三周期第ⅦA族.
(3)B为钠元素,B的最高价氧化物的水化物为NaOH,氢氧化钠由钠离子与氢氧根离子构成,电子式为
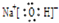
;钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成共价键.
故答案为:
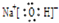
;离子键、共价键.
(4)非金属性越强,氢化物的稳定性越强,非金属性F>Cl>S,D的气态氢化物HCl、H2S、HF的热稳定性由强到弱顺序是HF>HCl>H2S.
故答案为:HF>HCl>H2S.
