已知反应 ①、②是化工生产中的两个重要反应:
①甲溶液
A+B+C电解
②乙经过粉碎后在沸腾炉中燃烧,得到D和E
其中,A、D在常温常压下为刺激性气味气体,C为无色无味气体.请回答:
(1)A的电子式是______.
(2)将A通入B的溶液中,反应的离子方程式是______.
(3)1g C在A中燃烧时放出92.3kJ的热量,该反应的热化学方程式是
______.
(4)工业上可利用E为原料冶炼其中所含的金属,方法是______.
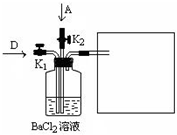
(5)将A和D按物质的量1:1通入如图装置中:
该过程中的化学方程式是______.
上述实验装置设计不完整,请将所缺部分在装置图的右边方框中画出.
(6)一定条件下,将12g乙放入过量的浓硝酸中,反应过程中转移1.5mol电子,该反应的离子方程式是______.
①化工生产中的甲溶液
A+B+C,且A为刺激性气体,C为无色无味气体,应为氯碱工业的重要反应,甲为NaCl溶液,A为Cl2,B为NaOH,C为H2;电解
②乙经过粉碎后在沸腾炉中燃烧,得到D和E,为硫酸工业的沸腾炉反应,生成的刺激性气体为SO2,E为Fe2O3,
(1)A为Cl2,为非金属单质,电子式为
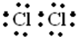
,故答案为:
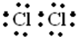
;
(2)A为Cl2,B为NaOH,二者反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)n(H2)=
=0.5mol,在Cl2中燃烧时放出92.3kJ的热量,则1molH2反应放出的热量为184.6kJ,反应的热化学方程式为H2(g)+Cl2(g)=2HCl(g);△H=-184.6kJ/mol,1g 2g/mol
故答案为:H2(g)+Cl2(g)=2HCl(g);△H=-184.6kJ/mol;
(4)工业冶炼铁通常用C作还原剂用热还原法冶炼,故答案为:热还原法;
(5)Cl2和SO2发生氧化还原反应反应生成硫酸和盐酸,加入反应生成,反应的化学方程式为Cl2 +SO2+BaCl2+2H2O=BaSO4↓+4HCl,Cl2和SO2都有毒,应用NaOH等强碱进行尾气吸收,如图
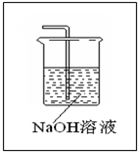
,故答案为:Cl2 +SO2+BaCl2+2H2O=BaSO4↓+4HCl;

;
(6)乙为FeS2,n(FeS2)=
=0.1mol,反应过程中转移1.5mol电子,则1molFeS2转移15mol电子,则Fe被氧化为+3价,S被氧化为+6价,反应的离子方程式为FeS2 +14H++15NO3-=Fe3++2SO42-+15 NO2↑+7H2O,12g 120g/mol
故答案为:FeS2 +14H++15NO3-=Fe3++2SO42-+15 NO2↑+7H2O.
