根据下列框图回答有关问题(答题时,方程式中的E用所对应的元素符号表示):
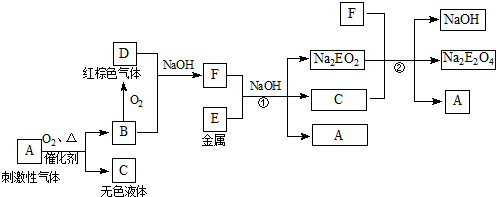
已知:Na2EO2溶于过量的新制氯水,形成黄色溶液,向该溶液中滴加KSCN溶液立即出现红色,振荡,一段时间后,红色褪去.
(1)A的电子式为______.
(2)写出反应②的化学方程式______.
(3)写出Na2EO2与新制氯水反应的离子方程式______.
(4)一段时间后红色褪去的原因可能是:
①E元素被氯水氧化为更高价态的物质;②______.
刺激性气体A能与氧气发生催化氧化,则A为NH3,无色液体C为H2O,B为NO,D为NO2,二者在碱性条件下生成F,F为
NaNO3,Na2EO2溶于过量的新制氯水,形成黄色溶液,向该溶液中滴加KSCN溶液立即出现红色,说明生成Fe3+,则E为Fe,
(1)A为NH3,电子式为
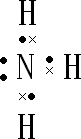
,故答案为:
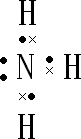
;
(2)A为NH3,C为H2O,F为NaNO3,由转化关系可知反应的化学方程式为NaNO3+2Na2FeO2+2H2O=NaOH+2Na2FeO4+NH3,
故答案为:NaNO3+2Na2FeO2+2H2O=NaOH+2Na2FeO4+NH3;
(3)Na2FeO2溶于过量的新制氯水,形成黄色溶液,向该溶液中滴加KSCN溶液立即出现红色,说明生成Fe3+,反应的离子方程式为2FeO22-+Cl2+8H+=2Cl-+2Fe3++4H2O,
故答案为:2FeO22-+Cl2+8H+=2Cl-+2Fe3++4H2O;
(4)一段时间后红色褪去,说明溶液中不存在Fe3+或SCN-,则可能为Fe元素被氯水氧化为更高价态的物质或KSCN被氯气氧化,故答案为:KSCN被氯水氧化.
