以下是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色.
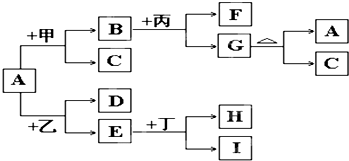
(1)若F是由Na+和SO42-组成的溶液,则甲的化学式是______,列举A物质的一种用途______.
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为______,丁属于单质、酸、碱中的______;在I溶液中加入氢氧化钠溶液,可以观察到的现象是______,对应的离子方程式和化学方程式依次是______,______;
(3)写出G→A+C的化学方程式:______.
(4)若A中混有杂质Al2O3,除去杂质的方法是加入过量的______,该反应的离子方程式为______.
(5)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1.则反应物中Fe2O3、Fe、H2SO4的物质的量之比为______.
其中A俗称铁红,化学式为Fe2O3;甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀判断为Fe(OH)3,C为H2O;I的颜色呈浅绿色,为亚铁离子的溶液;
(1)若F是由Na+和SO42-组成的溶液,则依据转化关系得到,甲为强酸H2SO4;A为Fe2O3;氧化铁的性质分析应用和用途,铁红是非常重要的一种防锈颜料,绝大多数的涂料都开发有铁红防锈漆,如醇酸铁红防锈漆、氯化橡胶铁红防锈漆和环氧铁红防锈漆.甚至在某些环氧富锌底漆中,都以铁红作为重要辅助防锈颜料;故答案为:H2SO4,用作红色油漆和涂料;
(2)若D是能使澄清石灰水变浑浊的气体,判断乙为还原性气体CO,还原氧化铁为铁和二氧化碳气体,E为Fe,铁和丁反应生成亚铁离子证明丁为稀酸;亚铁离子和碱氢氧化钠反应生成白色沉淀氢氧化亚铁,在空气中会被迅速氧化为氢氧化铁红褐色沉淀;反应的离子方程式和化学方程式为:Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:CO;酸;生成白色沉淀,迅速变为灰绿色,最终变为红褐色;Fe2++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)G→A+C的化学方程式变化为氢氧化铁受热分解生成氧化铁和水的反应;反应化学方程式为:2Fe(OH)3
Fe2O3+3H2O; △ .
故答案为:2Fe(OH)3
Fe2O3+3H2O; △ .
(4)氧化铁中含有氧化铝,利用氧化铝的两性进行除杂,氧化铝溶于强酸强碱溶液,氧化铁溶于强酸溶液,不溶于强碱溶液,加入过量氢氧化钠溶液,氧化铝溶解,氧化铁不溶解;反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O;故答案为:NaOH溶液;Al2O3+2OH-=2AlO2-+H2O;
(5)E和A组成的混合物依据上述分析判断为Fe和Fe2O3;与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1;
依据反应:Fe+H2SO4=Fe2++H2↑;
1 1 1 1
Fe+2Fe3+=3Fe2+;
1 2 3
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
1 3 1
反应物中Fe2O3、Fe、H2SO4的物质的量之比=1:2:4;
故答案为:1:2:4;
